
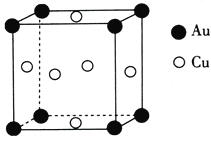
����Ŀ���л�����ӵĽṹʽϵһ��ƽ��ͼʾ��������ӳ�����и�ԭ�����ӵ�˳��ͷ�ʽ������ʾ�����и�ԭ�ӵĿռ����λ�ã��ṹʽ�б�ʾ���ۼ��Ķ��߳���Ҳ�����������������μ��İ���һ����Ҫ�Ļ���ԭ�ϣ���ṹʽ��ͼ��ʾ�����й��ڻ����μ��İ����ӽṹ����������ȷ����

A. ���������е�N��Cԭ�ӹ���
B. �ṹʽ�д�*��Nԭ�Ӵ��ڷ��ӵ�����
C. �����к���3����ͬ��C��N�������е���Ԫ��
D. ���ӷ����е�4��Nԭ�ӿɹ���һ����������
���𰸡�D
���������ɻ����μ��İ��Ľṹʽ��֪�����л���Ϊ���Ͷ�л�����е�̼ԭ�Ӷ��γ�4�����ۼ�����ԭ�Ӷ��γ�3�����ۼ�����ռ�ṹʾ��ͼΪ ���÷��Ӿ��и߶ȶԳƵĿռ�ṹ��
���÷��Ӿ��и߶ȶԳƵĿռ�ṹ��
A. �ɻ����μ��İ��Ľṹʽ��֪�����л���Ϊ���Ͷ�л�����е�̼ԭ�Ӷ��γ�4�����ۼ�����ԭ�Ӷ��γ�3�����ۼ�����ȼ��������������ṹ�������ӵ������ṹ�����л�����������е�N��Cԭ�Ӳ��ܹ�����A����ȷ��
B.���������Ǹ��߶ȶԳƵ���״�ṹ��4��Nԭ���ڽṹ��λ����ͬ��û��N���ڷ��ӵ����ģ� B����ȷ��
C. �����к���4����ͬ��C��N�������е���Ԫ����C����ȷ��
D. ���ӷ����е�4��Nԭ�ӿɹ���һ���������壬��ͼ ��D��ȷ��
��D��ȷ��
�������������ڻ����μ��İ��ķ��ӽṹ����������ȷ����D������ѡD��


 ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����ػ����������������о�����Ҫ�����á��ش�����������
��1��ͭԪ�������ڱ��е�λ����______________����̬ͭԭ�������������ռ������ܲ�ķ�����_________________��ռ�ݸ�����ܲ�ĵ�����Ϊ__________________��
��2����һ�������£�����������γɵĻ������Ϊ��������������Cu9Al4��Cu5Zn8�ȡ�ij��������������Է�����ԭ������ά�ռ���������������������ý�������������__________(����塱�Ǿ��塱)��
��3��ͭ������±��[(SCN)2]��Ӧ����Cu(SCN)2��1mol(SCN)2�����к�����������ĿΪ______________�� (SCN)2��Ӧ������������(H-S-C![]() N)����������(H-N=C=S)���֡�������ǰ�߷е���ں�������ԭ����____________________________��
N)����������(H-N=C=S)���֡�������ǰ�߷е���ں�������ԭ����____________________________��
��4��ͭ������ͭԭ�ӵĶѻ���ʽΪ���������ѻ���ÿ��ͭԭ����Χ���������ͭԭ�Ӹ���Ϊ________��
��5��ͭ����γɵĽ���������ľ����ṹ��ͼ��ʾ���侧���߳�Ϊa nm���ý�����������ܶ�Ϊ____________(�ú�a��NA�Ĵ���ʽ��ʾ)g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ�ֹ��ס���Ч����������������ˮ��������ˮ�����ȷ����й㷺Ӧ�á�������ijУ��ѧ�о�С�����ʵ������ȡClO2�Ĺ�������ͼ�������й�˵����ȷ���� (����)

A. ���ʱ������Ӧ�Ļ�ѧ����ʽΪ2HCl![]() Cl2����H2��
Cl2����H2��
B. ��NaClO2��Һ��ȡ0.6 mol ClO2ʱ����������0.1 mol NCl3
C. �������Ļ������ͨ��ʢ�м�ʯ�ҵĸ������Գ�ȥClO2�е�NH3
D. ��ҺX����Ҫ�ɷ�ΪNaClO2��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������������( )
A.������������ȼ�ղ�����ɫ����
B.����ˮ������Ӧ�����ɺ�ɫ�Ĺ���
C.�п��Ľ�����¶���ڿ����У�����ܿ��䰵
D.����ĥ���������ھƾ����ϼ��ȣ������ۻ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ؿ�������������������ѧ��ѧ����������������ҵ�ϣ������̿��Ƹ�����ص��������£����������Ͳ���ʡ�ԣ���

��ش��������⣺
��1���������ؽ����ʣ�������������������������֮�ȣ��Ĵ�ʩ��______ ���δ�һ��ɣ�
��2��д���������̺�����������������ͨ�����ʱ��������Ҫ��ѧ��Ӧ�ķ���ʽ��______��
��3���Ӿ����Կ����Լ�X��ѡ�������ƣ���___________�����������У���Ʋ���IV��V��Ŀ����___��
��4���Զ��Բ���Ϊ�缫�����õ���������Һ�ķ�����ɲ���IIIת����
��������ӦʽΪ______��
�ڵ������У����������������Һ��pH��________�������С�䣩��
��5���ⶨ���������Ʒ���ȣ�����������Һ�еζ���������Һ��������ɫ����������Һ���Ϻ�ɫ�պ���ɫ�Ұ���Ӳ���ɫ�������ﵽ�ζ��յ㡣д�����ӷ���ʽ��________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ҩƷ���һ���ɺ��������ʵĵ�ʯ������Ȳ������Ʊ������������飬����ͨ������ȷ����Ȳ���ʵ�ϵ��ʵ��װ�ã���ˮ��Ũ��Ϊ0.1 mol/L�������20mL��NaOH��Һ������
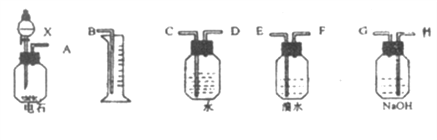
��1����������������������ʱ������ʵ��ʱ��������ȷ����˳���ǣ���A��B������ ____ �� �� �� �� �� �� �� ��
��2��Ϊ��ʹʵ��������ƽ�ȣ�Һ��Xͨ����_________________________��
��3��ʵ����ʢ��ˮ��ƿ�пɹ۲쵽��������_________________________��
��4���ٶ���ˮ����Ȳ��ȫ��Ӧ������C2H2Br4���ú�amol̼���Ƶĵ�ʯWg������X��Ӧ����Ӧ��ȫ����Ͳ��������VLҺ��(�ڱ�״���²ⶨ)������Ȳ�IJ���Ϊ_____________________��ֻ���г���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��X��Y��Z��M��N��O��Ϊ����������Ԫ�أ���ԭ����������������֪X���������൱��һ����¶�����ӣ�YԪ��ԭ������������������������֮��Ϊ3��4��NԪ��ԭ�ӵ����������������������֮��Ϊ3��4��Z��M��Oλ��ͬһ���ڣ�����Ԫ��ԭ�ӵ�����㹲��11�����ӣ���������Ԫ�ص�����������ˮ����֮���������ܷ�Ӧ���������κ�ˮ.
�ݴ˻ش��������⣺
��1��д������Ԫ�صķ��ţ�X________��Z________��M_________��N___________��
��2��X��Y�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�д����18���ӷ���ת����10���ӷ��ӵĻ�ѧ����ʽ��_______(�ֽⷴӦ)��
��3��X��Z�����γ�һ�����ӻ�����ڸû�������ZΪ+1�ۣ����Ժ�ˮ��Ӧ����������д���û������ˮ��Ӧ�Ļ�ѧ����ʽ��____��
��4��Z��M����Ԫ������������ˮ����֮�䷴Ӧ�Ļ�ѧ����ʽΪ_____��
��5��������ʵ��˵��Ԫ��O�ķǽ����Ա�Ԫ��N�ķǽ�����ǿ����_______��
a��Ԫ��O�γɵĵ��ʱ�Ԫ��N�γɵĵ��ʵ��۵��
b��O��N��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
c��O2ͨ�뵽X2N����Һ�г��ֻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����( )
A.���³�ѹ�£�11.2 L����������ԭ����ΪNA
B.��״���£�1.12 L H2O������ԭ����Ϊ0.1NA
C.1.8 g NH4+�����к��еĵ�����ΪNA
D.71g Cl2��ˮ��Ӧʱ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��ͬѧΪ��֤�����Ƚ�SO2����ˮ��Ư����,���������ͼ��ʾ��ʵ��װ�á�

(1)ʵ���ҳ�ѡ����CO2�ķ���װ����SO2;ʵ��������MnO2��Ũ���ᷴӦ�Ʊ�Cl2ʱ,Ӧѡ����ͼA��E������װ����______װ��(��װ�����)��Cl2������Cl2�ķ�Ӧ��Ũ���������ֳ���������______.
(2)Ӧ��ʼ��,����B��D�����Թ��е�Ʒ����Һ����ȥ,ֹͣͨ����,��B��D�����Թܼ���,�����Թ��е�����ֱ�ΪB:________, D:_________.
(3)װ��C��������__________��
(4)��������ͬѧ�ֱ�������ͼ��ʾװ��̽���������尴��ͬ������Ϻ��Ư����,�Է���:
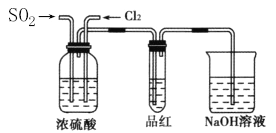
�����������Ʒ����Һ֮ǰ,�Ƚ�SO2��Cl2ͨ��ʢ��Ũ����װ�õ�Ŀ����____________��
�ڼ�ͬѧ��ʵ������з���:ͨ��һ��ʱ���,Ʒ����Һ��������ɫ����ԭ���� ,��д������Ӧ�����ӷ���ʽ:_________.
����ͬѧ��ʵ������з���:ͨ��һ��ʱ���,Ʒ����Һ��ɫ��ʱ�����Ʊ��Խ��Խdz����ԭ��________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com