
����Ŀ��������ؿ�������������������ѧ��ѧ����������������ҵ�ϣ������̿��Ƹ�����ص��������£����������Ͳ���ʡ�ԣ���

��ش��������⣺
��1���������ؽ����ʣ�������������������������֮�ȣ��Ĵ�ʩ��______ ���δ�һ��ɣ�
��2��д���������̺�����������������ͨ�����ʱ��������Ҫ��ѧ��Ӧ�ķ���ʽ��______��
��3���Ӿ����Կ����Լ�X��ѡ�������ƣ���___________�����������У���Ʋ���IV��V��Ŀ����___��
��4���Զ��Բ���Ϊ�缫�����õ���������Һ�ķ�����ɲ���IIIת����
��������ӦʽΪ______��
�ڵ������У����������������Һ��pH��________�������С�䣩��
��5���ⶨ���������Ʒ���ȣ�����������Һ�еζ���������Һ��������ɫ����������Һ���Ϻ�ɫ�պ���ɫ�Ұ���Ӳ���ɫ�������ﵽ�ζ��յ㡣д�����ӷ���ʽ��________
���𰸡����ȡ������2MnO2��4KOH��O2![]() 2K2MnO4��2H2Oʯ���飨����ʯ�ң�ѭ�����ö������̡��������أ����ԭ��������MnO42-��e-��MnO4-����2MnO4-��3Mn2+��2H2O��5MnO2����4H+
2K2MnO4��2H2Oʯ���飨����ʯ�ң�ѭ�����ö������̡��������أ����ԭ��������MnO42-��e-��MnO4-����2MnO4-��3Mn2+��2H2O��5MnO2����4H+
��������
���̿����Ҫ�ɷ�ΪMnO2���ɹ�������ת����ϵ��֪��MnO2��KOH�����ڻ������ͨ�����ʱ������Ӧ����K2MnO4����K2MnO4��Һ��ͨ��CO2�Ʊ�KMnO4��������K2CO3��MnO2��ͨ�����ˣ�������������̣���Һ�к�KMnO4��K2CO3������KMnO4��K2CO3���ܽ����ϲ�ͬ���������ᾧ�ķ�ʽ�ɷ����������غ�̼��أ��Դָ�����ؽ����ؽᾧ������õ������ĸ�����أ���̼�����Һ�м���ʯ������̼��ƺ��������ء�
��1����Ũ�ȡ��¶ȵ�Ӱ�컯ѧ��Ӧ���ʵĽǶȿ�֪����߽����ʣ�����������Ũ�ȡ������¶ȡ�������߽��������ӽ���ʱ��ȡ���2���ɹ�������ת����ϵ��֪��MnO2��KOH�����ڻ������ͨ�����ʱ������Ӧ����K2MnO4������Ԫ���غ㻹Ӧ����ˮ����Ӧ����Ԫ����+4������Ϊ+6�ۣ�������2�ۣ���Ԫ����0�۽���Ϊ-2�ۣ��ܹ�����4�ۣ����ϼ�������С������Ϊ4������MnO2ϵ��2��O2ϵ��Ϊ1��������Ԫ���غ�ȷ��K2MnO4ϵ��Ϊ2�����ݼ�Ԫ���غ�ȷ��KOHϵ��Ϊ4��������Ԫ���غ�ȷ��H2Oϵ��Ϊ2�����Է�Ӧ��ѧ����ʽΪ2MnO2+4KOH+O2![]() 2K2MnO4+2H2O����3���Լ�X�ǽ�̼��ط�Ӧ�����������أ����ԴӾ����Կ����Լ�X��ѡ��ʯ���飨����ʯ�ң������������У�����IV��V��������ѭ�����ã���Ŀ����ѭ�����ö������̡��������أ����ԭ�������ʡ���4������������Һʱ�����������������ʧ�������ɸ���������ӣ��缫��ӦʽΪMnO42--e-=MnO4-��������ˮ�õ����������������������ӣ��缫��ӦΪ2H2O+2e-=H2��+2OH-����������Һ��pH����5���ø��������Һ�ζ���������Һ��������ɫ������������Ӧ�����ӷ���ʽΪ2MnO4-+3Mn2++2H2O
2K2MnO4+2H2O����3���Լ�X�ǽ�̼��ط�Ӧ�����������أ����ԴӾ����Կ����Լ�X��ѡ��ʯ���飨����ʯ�ң������������У�����IV��V��������ѭ�����ã���Ŀ����ѭ�����ö������̡��������أ����ԭ�������ʡ���4������������Һʱ�����������������ʧ�������ɸ���������ӣ��缫��ӦʽΪMnO42--e-=MnO4-��������ˮ�õ����������������������ӣ��缫��ӦΪ2H2O+2e-=H2��+2OH-����������Һ��pH����5���ø��������Һ�ζ���������Һ��������ɫ������������Ӧ�����ӷ���ʽΪ2MnO4-+3Mn2++2H2O
=5MnO2��+4H+��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AG��ʾ��Һ����ȣ������ʽΪ��![]() �������£�ʵ��������0.1mol/L��������Һ�ζ�10mL 0.1mol/L MOH��Һ���ζ���������ͼ��ʾ������˵����ȷ����
�������£�ʵ��������0.1mol/L��������Һ�ζ�10mL 0.1mol/L MOH��Һ���ζ���������ͼ��ʾ������˵����ȷ����
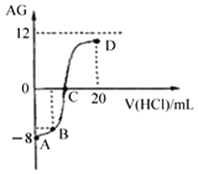
A. �õζ����̿�ѡ���̪��Ϊָʾ��
B. C��ʱ����������Һ���������10 mL
C. ��Һ����ˮ�����c(H+)��C��>D��
D. ��B������������Һ���Ϊ5 mL��������Һ�У�c(M+)+c(H+)= c(MOH)+ c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���������ͼװ����ȡ����֤SO2�����ʡ�

��ش�
��1��д��A��Ӧװ���еĻ�ѧ����ʽ��____________
��2��������NaOH��Һ��������________________
��3��Ϊ����֤SO2�����������ϴ��ƿ���п�ѡ����Լ���_________��
A������ʯ��ˮ B����ɫ��̪��Һ C����ˮ D����ɫʯ����Һ
��4������˵����ȷ����____________��
A������װ���м����Լ���ҩƷ�����ٽ��������Լ��
B��ʵ�鿪ʼʱ��ֻ���Һ©��������������ʹҺ��˳������
C��ʵ�鿪ʼ��ϴ��ƿ����������Һ����ɫ�����߾���֤��SO2����Ư����
D��ʵ�鿪ʼ��ϴ��ƿ���пɹ۲쵽��ɫ�����������������˵��SO2���л�ԭ��
��5��д��ϴ��ƿ���з�Ӧ�Ļ�ѧ����ʽ��_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��O������һ�����ʣ���O���������ʾ��ɶ�����Ԫ����ɣ�����֮���ת����ϵ����ͼ��ʾ����Ӧ�����ԣ���A��B��H�ֱ��ǵ��ʡ�B����ˮ������Ӧ�����ˮѸ�ٷ�Ӧ���ų�������D��һ�����ӻ�������������ӵĸ�����Ϊ2�U3��������ˮ����Ӧ�õ����ּCΪ����ɫ���廯���O����G��ˮ��Һ��Ӧ������ɫ������

��ش��������⣺��1�����B���ʵ�Ԫ��λ�����ڱ���_____���ڣ���___�塣������C��D�ĵ���ʽΪ_______ ��_______ ��
��2��J�ķе�������⣨H2Se���ķе�ߣ���ԭ����_______��
��3��д��I��H�ڴ����������·�Ӧ����L��J�Ļ�ѧ����ʽ��_______________
��4��д��G��F���ȷ�Ӧ����K��I��J�Ļ�ѧ����ʽ��______________________��
��5����ͼ����ͬһ��Ӧ��һ����������������������ԭ���������ķ�Ӧ����____����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ������ƿ�ڳ���ij���壬���ι��ڵ�ˮ���뼯��ƿ���ձ��е�ˮ����뼯��ƿ������ƿ�����������

��NH3 ��N2��H2 ��NO2��O2 ��SO2 ��SO2��Cl2
A. �٢ڢۢܢ� B. �٢ڢ� C. �٢ۢܢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����ӵĽṹʽϵһ��ƽ��ͼʾ��������ӳ�����и�ԭ�����ӵ�˳��ͷ�ʽ������ʾ�����и�ԭ�ӵĿռ����λ�ã��ṹʽ�б�ʾ���ۼ��Ķ��߳���Ҳ�����������������μ��İ���һ����Ҫ�Ļ���ԭ�ϣ���ṹʽ��ͼ��ʾ�����й��ڻ����μ��İ����ӽṹ����������ȷ����

A. ���������е�N��Cԭ�ӹ���
B. �ṹʽ�д�*��Nԭ�Ӵ��ڷ��ӵ�����
C. �����к���3����ͬ��C��N�������е���Ԫ��
D. ���ӷ����е�4��Nԭ�ӿɹ���һ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�ĵ��ʡ������Ǧ�����ִ���ҵ��������Ҫ����;��
��1����ҵ����пұ�������е�Ǧ������������Ǧ���������£���֪Ǧ��������Ҫ�ɷ���PbO��Pb������������Ag��Zn��CaO��������������������ʡ�

�����������У�����ʹ���������Ժ�������Ǧ���ʣ���Ŀ����_________����Һ�д��ڿ�ѭ�������ڵ����ʣ���������_______ �� ��40�������Ŀ���� _______
��д����������е���Ǧ��Ӧ�Ļ�ѧ����ʽ��______���������ﺬ�м�����CaSO4����ϴ�Ӽ����ʹ��____
a��ˮ b��10%���ᡢˮ c��Pb(NO3)2��Һ��ˮ
��2����֪Ǧ���γɶ�������������������PbO������������PbO2�Լ�Pb3O4��Pb3O4�������ᷢ����������ԭ��Ӧ����һ���κ�һ��Ǧ�������д����Ӧ�Ļ�ѧ����ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��Ϊ������Ԫ�أ����ǵ�ԭ���������ε����� A�������Ϊһ�����ӵķǽ���Ԫ�أ�C ԭ�ӵ������������Ǵ�����3���� C��D���γ����ֹ�̬���������һ��Ϊ����ɫ���壻B��C���γɶ�����̬�����A��B��C����Ԫ�ؿ����γ����Ӿ��壬�þ����и�Ԫ��ԭ�ӵ����ʵ���֮��ΪA:B:C=4:2:3��
��ش��������⣺
��1��д��B��ԭ�ӽṹʾ��ͼ______��д��C��D�γɵĵ���ɫ���廯����ĵ���ʽ_____��
��2��Ԫ��ԭ�ӵ����ʵ���֮��ΪA:B:C=4:2:3�ľ�������Ϊ__________��
��3����д����A2C��BA3�����е�������ͬ��������A��B��CԪ������������Ԫ����ɵ����ķ��ţ���������____��_____��
��4��д����B��CԪ�������Ԫ��ԭ��������ΪB:C=7:12�Ļ�����Ļ�ѧʽ _______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300mL0.5mol/L��FeCl3��Һ��0.2L1.0mol/L��KCl��Һ��Cl����Ũ��֮��Ϊ
A. 1��2B. 3��2C. 3��4D. 9��4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com