
【题目】请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算确定乙炔产率的系列实验装置,溴水的浓度为0.1 mol/L,体积是20mL,NaOH溶液足量。
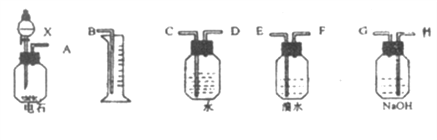
(1)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是(填A、B、…) ____ 接 ; 接 ; 接 ; 接 。
(2)为了使实验中气流平稳,液体X通常用_________________________。
(3)实验中盛溴水的瓶中可观察到的现象是_________________________。
(4)假定溴水与乙炔完全反应,生成C2H2Br4,用含amol碳化钙的电石Wg与足量X反应,反应完全后,量筒内排入了VL液体(在标准状况下测定),则乙炔的产率为_____________________(只需列出算式)。
【答案】 A,H,G,E,F,D,C,B 饱和食盐水 溴水褪色 ![]()
【解析】由题中信息可知,电石与水反应生成的乙炔中含有硫化氢,该气体经氢氧化钠溶液洗气后,硫化氢可以被氢氧化钠溶液吸收,气体再通入溴水中与溴发生加成反应,乙炔与溴的加成产物为无色液体,余气经排水测气可以测出剩余气体的体积。
(1)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是A接H、 G接E、F接D、C接B。
(2)为了使实验中气流平稳,液体X通常用饱和食盐水。
(3)实验中盛溴水的瓶中可观察到的现象是溴水褪色。
(4)假定溴水与乙炔完全反应,生成C2H2Br4,20mL 0.1 mol/L的溴水中含0.002mol Br2,可以吸收0.001mol的乙炔。含amol碳化钙的电石Wg与足量X反应,理论上可以生成a mol 乙炔,反应完全后,量筒内排入了VL液体(在标准状况下测定),说明剩余乙炔的物质的量为![]() mol,则乙炔的产率为
mol,则乙炔的产率为![]() 。
。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
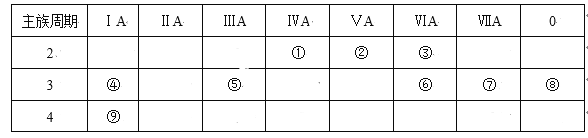
(1)在这些元素中,化学性质最不活泼的是:_____(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是:_____。
(3)最高价氧化物是两性氧化物的元素是___;写出它的氧化物与氢氧化钠反应的离子方程式__。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:______。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________。
(6)用结构式表示元素①与③形成的化合物____,该化合物在固体时俗称___,属于____晶体,指出它的一种用途___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述不正确的是( )

A. 有机物化学式为![]() B. 分子中所有原子在同一个平面内
B. 分子中所有原子在同一个平面内
C. 该有机物难溶于水![]() D. 可由乙炔和氯化氢加成得到
D. 可由乙炔和氯化氢加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子的结构式系一种平面图示,它仅反映分子中各原子连接的顺序和方式,不表示分子中各原子的空间相对位置,结构式中表示共价键的短线长度也不代表键长.环六次甲基四胺是一种重要的化工原料,其结构式如图所示.下列关于环六次甲基四胺分子结构的叙述中正确的是

A. 分子中所有的N,C原子共面
B. 结构式中打*的N原子处于分子的中心
C. 分子中含有3个相同的C,N交替排列的六元环
D. 连接分子中的4个N原子可构成一个正四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下:
① 在250mL的圆底烧瓶中放入17.7 mL苯,配上一个双孔橡皮塞,一个孔插入一支100℃温度计,其水银球要进入液面下,另一个孔插入长颈漏斗,仪器装置如图所示。

②通过长颈漏斗上口将已配制好的混酸分多次加入烧瓶中。每加一次,必须振荡烧瓶,当反应物温度不再上升而趋下降时,才可继续加混酸。反应温度应保持在40—50℃,若超过50℃,可用冷水浴冷却烧瓶,加料完毕后,把烧瓶放在水浴上加热,约10分钟内把水浴加热到55-60℃,并保持30分钟,间歇地振荡烧瓶。
③冷却后将反应物倒入分液漏斗,静置分层,分出酸液和粗硝基苯,由于工业浓H2SO4中含有少量汞盐等杂质有催化作用,使反应产物中含有苦味酸(2,4,6-三硝基苯酚)和2,4-二硝基苯酚使粗硝基苯呈浅黄色,此外还含有间二硝基苯。已知:苦味酸与2,4-二硝基苯酚均有酸性,能与碱反应;间二硝基苯性质与硝基苯类似。请回答下列问题
(1)步骤①中长颈漏斗的作用
a _______________________,b _______________。
(2)步骤 ②中,每加入一次混酸,必须振荡烧瓶的目的_____________________。
(3)步骤②中,需严格控制温度的原因___________________________________。
(4)步骤③中,静置分层后,粗硝基苯在分液漏斗_____ 层。
(5)要将粗硝基苯中混有少量酸液、苦味酸、2,4一二硝基苯酚以及二硝基苯,除去得到纯净的硝基苯必须进行的五步操作名称为a __________ 、 b _____________、c _________ 、 d _____________、e_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L1硫酸、6 mol·L1盐酸和蒸馏水)

回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________。
(2)装置B的作用是______________,装置C的作用是______________,装置E的作用是_____________。
(3)装置D中发生反应的化学方程式是______________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素
A. 在周期表中处于第三周期ⅦA族 B. 在周期表中处于第二周期ⅤA族
C. 氢化物稳定性比PH3弱 D. 常见化合价只有-3、+2、+3、+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物和足量的银氨溶液在微热条件下发生银镜反应,生成10.8 g银,而燃烧等量的有机物时,需消耗氧气6.16 L(标准状况),该有机物是( )
A. 葡萄糖 B. 甲酸乙酯 C. 丁醛 D. 乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com