
| 4.4g |
| 44g/mol |
| 2.16g |
| 18g/mol |
| 0.1mol |
| 0.02mol |
| 0.12mol×2 |
| 0.02 |
 ,新戊烷最长碳链含有3个C,主链为丙烷,在2号C含有2个甲基,新戊烷的系统命名法命名为:2,2-二甲基丙烷,
,新戊烷最长碳链含有3个C,主链为丙烷,在2号C含有2个甲基,新戊烷的系统命名法命名为:2,2-二甲基丙烷, ;2,2-二甲基丙烷;3;
;2,2-二甲基丙烷;3;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 ①钠离子交换膜的一种材料是聚丙烯酸钠
①钠离子交换膜的一种材料是聚丙烯酸钠 ,聚丙烯酸钠单体的结构简式是
,聚丙烯酸钠单体的结构简式是2- 7 |
2- 7 |
| 3 | 0.4 |
| 3 | 4 |
| 3 | 6 |
| 3 | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:

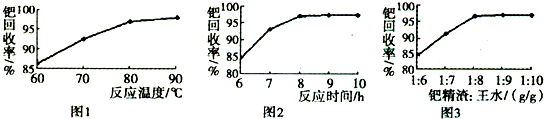
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Fe2+、Cl-、SO42- |
| B、Na+、K+、Cl-、SO42- |
| C、Mg2+、H+、Cl-、SO42- |
| D、K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com