
下列离子方程式中,不正确的是
A.向FeCl2溶液中通入Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Clˉ
B.FeCl3溶液跟过量氨水 Fe3+ + 3NH3•H2O = Fe(OH)3↓ + 3NH4+
C.碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.钠与水的反应 2Na + 2H2O = 2Na+ + 2OH- + H2↑
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空
(1)写出B、D的化学式:B ,D 。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素R、T、Q、W在元素周期表中的相对位置如右下图所示,T元素的最高正价与最低负价的代数和为0。下列判断正确的是
| R | ||
| T | Q | W | |
A.原子半径的大小:W>Q>R
B.气态氢化物的稳定性:R>Q>T
C.对应含氧酸的酸性强弱:W>Q>T
D.R分别与T、Q、W形成化合物的晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下Cu2S与稀HNO3发生反应,所得还原产物为NO,氧化产物为Cu2+和SO42—。现将0.06molCu2S加入到50mL、4mol/LHNO3中,充分反应之后,下列说法正确的是( )
A.被还原的硝酸为0.2mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1 (溶液体积不变) D.Cu2S未全部参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐x(仅含四种元素)的组成和性质.设
计并完成了如下实验
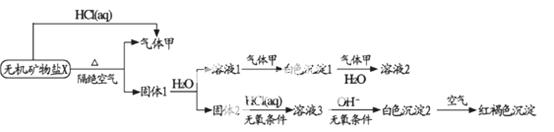
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答下列问题:
(1)X的化学式为 ,在隋性气流中加热X至完全分解的化学反应方程式为
。
(2)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 。并设计实验方案验证该反应的产物 。
(3)白色沉淀1中金属元素的原子结构示意图为 ,气体甲的电子式为 。
(4)自色沉淀2在空气中变成红褐色沉淀的原因是 。
(用化学反应方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
 ① 温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ _.
① 温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ _.
② 为提高上述反应CH4的转化率,可采取的措施有
_ (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体区别于其它分散系的本质特征是
A.胶体粒子直径在1-100nm之间 B. 胶体具有吸附性
C.胶体是一种介稳性的分散系 D. 光束通过胶体时有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置或操作进行相应实验,能达到实验目的的是
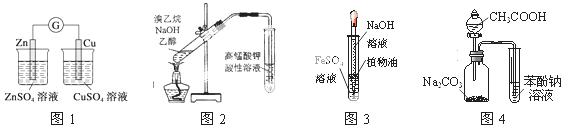
A.用图1装置验证化学能转化为电能
B.用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.用图3装置制备氢氧化亚铁
D.利用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.羟基的电子式: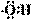
B.淀粉和纤维素的实验式:CH2O
C.CH4分子的球棍模型:
D.原子核内含有77个质子、115个中子的铱(Ir)原子:11577Ir
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com