
某研究小组为了探究一种无机矿物盐x(仅含四种元素)的组成和性质.设
计并完成了如下实验
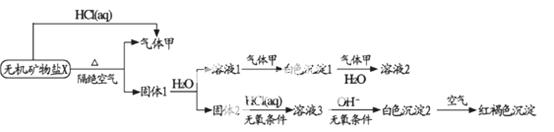
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答下列问题:
(1)X的化学式为 ,在隋性气流中加热X至完全分解的化学反应方程式为
。
(2)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 。并设计实验方案验证该反应的产物 。
(3)白色沉淀1中金属元素的原子结构示意图为 ,气体甲的电子式为 。
(4)自色沉淀2在空气中变成红褐色沉淀的原因是 。
(用化学反应方程式表示)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为0.1NA B.x=2y
C.沉淀是Mg(OH)2和Al(OH)3的混合物 D.2x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要480 mL0.4 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线下1 cm--2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2次--3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为_________(填序号)。
(2)实验室有如下规格的容量瓶:①100mL ②250mL
③500 mL ④1000 mL,本实验选用____(填序号)。
 (3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有_________________。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有_________________。
(4)需要使用玻璃棒的操作有_______(填序号),其作用为___________________。
(5)误差分析:(填“偏高”“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码):_________
②某同学观察液面的情况如图所示:__________。
③没有进行操作步骤④:____________________。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:____________。
⑤容量瓶原来有少量水:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ba(AlO2)2可溶于水。下图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。
 说明:AlO2-即[Al(OH)4]-
说明:AlO2-即[Al(OH)4]-
下列有关叙述正确的是( )
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:整个阶段Ba2+一定不会等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,不正确的是
A.向FeCl2溶液中通入Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Clˉ
B.FeCl3溶液跟过量氨水 Fe3+ + 3NH3•H2O = Fe(OH)3↓ + 3NH4+
C.碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.钠与水的反应 2Na + 2H2O = 2Na+ + 2OH- + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1) S2O32-能被I2氧化为S4O62-; (2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ. 市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2: | |
| 步骤3: |
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
② 滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2 S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次.
S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次.
(1) 步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2) 完成并配平步骤②中的离子反应:
Cr2O72-+ ( )+ I- == I2 + Cr3++ H2O
(3) 步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4) 若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。
(Na2S2O3的摩尔质量为158g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)(4分)有下图所示A、B、C、D四种仪器:
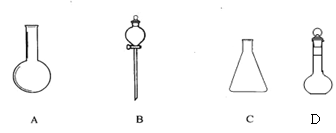 |
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥容量瓶
A ______________ B______________C______________D______________
(2)(4分)实验室检验某溶液中是否含有SO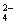 的操作方法是:
的操作方法是:
;
实验室检验某溶液中是否含有Cl-的操作方法是:
。
(3)(4分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙______。 (2)分离碘和水的混合物____ __。
(3)分离水和汽油的混合物______。 (4)分离酒精和水的混合物______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com