
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH—=BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO—+2H2O =Fe(OH)2↓+2HC1O
C.NH4HSO3溶液与足量NaOH溶液反应:NH+4+OH—=NH3↑+H2O
D.将1mol/LNaAlO2溶液和1.5mol/L的HC1溶液等体积均匀混合:
6AlO—2+9H++3H2O=5Al(OH)3↓+Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:R-CH=CH2 + HBr →R-CHBr-CH3(主要产物)。有机物A、B分别是化学式为C3H7Br的两种同分异构体,B是E和溴化氢反应的主要产物,A~E各物质之间的转化关系如下图所示。
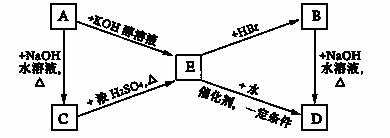
请回答下列问题:
(1)A、D的结构简式分别是 . 。
(2)由E转化为D的反应类型是 。
(3)写出下列反应的化学方程式:
①由A转化为E的化学方程式为
②D与由C氧化生成的羧酸反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素R、T、Q、W在元素周期表中的相对位置如右下图所示,T元素的最高正价与最低负价的代数和为0。下列判断正确的是
| R | ||
| T | Q | W | |
A.原子半径的大小:W>Q>R
B.气态氢化物的稳定性:R>Q>T
C.对应含氧酸的酸性强弱:W>Q>T
D.R分别与T、Q、W形成化合物的晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
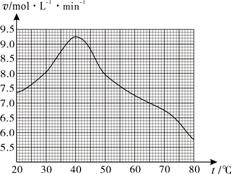 (1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0 mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为 。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0 mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为 。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是 。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O Cu(CO)Cl·H2O DH<0
Cu(CO)Cl·H2O DH<0
要加大CO的吸收率,适宜的条件是 。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为 ,所得溶液的物质的量浓度为 。
(5)工业检测CuCl产品的纯度需要80 mL 0.5 mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下Cu2S与稀HNO3发生反应,所得还原产物为NO,氧化产物为Cu2+和SO42—。现将0.06molCu2S加入到50mL、4mol/LHNO3中,充分反应之后,下列说法正确的是( )
A.被还原的硝酸为0.2mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1 (溶液体积不变) D.Cu2S未全部参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐x(仅含四种元素)的组成和性质.设
计并完成了如下实验
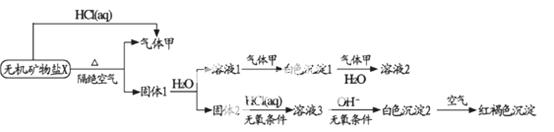
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答下列问题:
(1)X的化学式为 ,在隋性气流中加热X至完全分解的化学反应方程式为
。
(2)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 。并设计实验方案验证该反应的产物 。
(3)白色沉淀1中金属元素的原子结构示意图为 ,气体甲的电子式为 。
(4)自色沉淀2在空气中变成红褐色沉淀的原因是 。
(用化学反应方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体区别于其它分散系的本质特征是
A.胶体粒子直径在1-100nm之间 B. 胶体具有吸附性
C.胶体是一种介稳性的分散系 D. 光束通过胶体时有丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com