
短周期主族元素R、T、Q、W在元素周期表中的相对位置如右下图所示,T元素的最高正价与最低负价的代数和为0。下列判断正确的是
| R | ||
| T | Q | W | |
A.原子半径的大小:W>Q>R
B.气态氢化物的稳定性:R>Q>T
C.对应含氧酸的酸性强弱:W>Q>T
D.R分别与T、Q、W形成化合物的晶体均为分子晶体
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
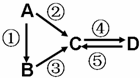
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:__________________________________。
(4)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:__________________________。
(5)若A为淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质. B与C可反应生成A。请写出B的电子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是 ( )
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要480 mL0.4 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线下1 cm--2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2次--3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为_________(填序号)。
(2)实验室有如下规格的容量瓶:①100mL ②250mL
③500 mL ④1000 mL,本实验选用____(填序号)。
 (3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有_________________。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有_________________。
(4)需要使用玻璃棒的操作有_______(填序号),其作用为___________________。
(5)误差分析:(填“偏高”“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码):_________
②某同学观察液面的情况如图所示:__________。
③没有进行操作步骤④:____________________。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:____________。
⑤容量瓶原来有少量水:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应。有关数据如下:
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
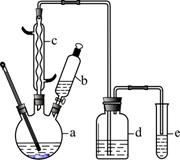
请回答下列问题:
(1)仪器c的名称为 。
(2)将b中液溴缓慢滴入a瓶的无水苯及铁的混合体系中,充分反应即可得到溴苯,通过下列步骤分离提纯:
①向a中加入10 mL水,然后 除去未反应的铁屑;
②产品依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。此过程需要分液操作,分液时溴苯应从 (填仪器名称)的 (填“上口”、“下口”)分离出。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,必须进行的操作是 。
(4)装置d中所装的试剂为 ,作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,进行的操作及现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,不正确的是
A.向FeCl2溶液中通入Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Clˉ
B.FeCl3溶液跟过量氨水 Fe3+ + 3NH3•H2O = Fe(OH)3↓ + 3NH4+
C.碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.钠与水的反应 2Na + 2H2O = 2Na+ + 2OH- + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
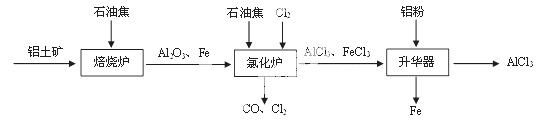
(1)焙烧炉中发生反应:①Fe2O3(s) +3C(s)  2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K= ▲ 。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为 ▲ ;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为 ▲ 。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25 g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为 ▲ 。
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为 ▲ 、
▲ ,F中所盛放试剂的作用是 ▲ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com