
【题目】下列各组原子结构示意图中,所表示的两种元素具有相似化学性质的是( )
A.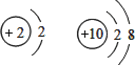
B.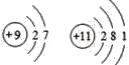
C.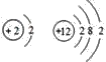
D.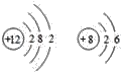
【答案】A
【解析】
从原子结构的观点看,与元素化学性质关系最密切的是最外层电子数,一般最外层电子数相同,化学性质相似。原子核外最外层有8个电子(K层为最外层时2个电子)的结构,是一种稳定结构。
A. 是氦和氖元素,属于稀有气体,化学性质相似,故A正确;
是氦和氖元素,属于稀有气体,化学性质相似,故A正确;
B. 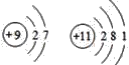 是氟和钠元素,氟属于卤素,容易得到一个电子达到稳定的结构,具有很强的非金属性,钠属于碱金属元素,容易失去一个电子达到稳定结构,具有很强的金属性,化学性质不相似,故B错误;
是氟和钠元素,氟属于卤素,容易得到一个电子达到稳定的结构,具有很强的非金属性,钠属于碱金属元素,容易失去一个电子达到稳定结构,具有很强的金属性,化学性质不相似,故B错误;
C. 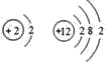 是氦和镁元素,氦属于属于稀有气体,化学性质稳定,镁属于碱土金属,具有较强的金属性,化学性质不相似,故C错误;
是氦和镁元素,氦属于属于稀有气体,化学性质稳定,镁属于碱土金属,具有较强的金属性,化学性质不相似,故C错误;
D. 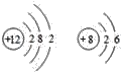 是镁和氧元素,镁属于碱土金属元素,具有较强的金属性,氧属于
是镁和氧元素,镁属于碱土金属元素,具有较强的金属性,氧属于
氧族元素,有较强的非金属性,化学性质不相似,故D错误;
答案选A。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室可以用排饱和食盐水的方法收集氯气
B. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C. 高压有利于工业上合成氨
D. 打开汽水瓶时,瓶中立即泛起大量泡沫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g)+O2(g)![]() 2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
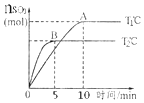
(1)反应后18O原子存在于哪些物质中___(填化学式)。
(2)上述反应的温度T1___ T2(填“>”“<”或“=”)。
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,则:
①平衡时体系内所含物质总的物质的量为___。
②平衡时SO3的浓度为___。
③下列说法不正确的是___。
A.如在该反应体系中加入适当的催化剂,可加快化学反应速率
B.其它条件相同时,该反应在T1时生成SO3的速率比T2时的小
C.该反应到达平衡时,体系内各组分的体积分数保持不变
D.若密闭容器中混合气体密度不变,则该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明连花清瘟制剂中的金丝桃苷是对新冠病毒主要蛋白酶最可能的抑制剂。其结构如图所示。下列说法错误的是( )
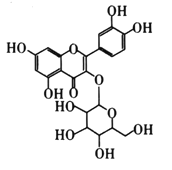
A.金丝桃的苷分子式为C21H20O12
B.金丝桃苷中所有碳原子不可能在同一平面上
C.金丝桃苷既能发生取代反应、氧化反应,还能使溴的四氯化碳溶液褪色
D.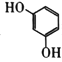 苯环上的二氯代物有5种
苯环上的二氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1000molL-1NaOH溶液滴定20mL0.1000molL-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.H3PO4的电离平衡常数Ka1约为10-2
B.当V(NaOH溶液)=40mL时,c(PO![]() )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO![]() )+2c(H3PO4)
)+2c(H3PO4)
C.当pH=7时,c(Na+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO![]() )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
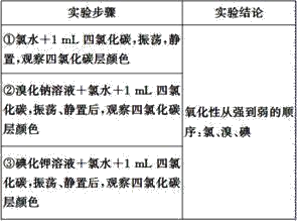
实验药品:溴化钠溶液、碘化钾溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是__、__。
(2)②中反应的化学方程式为__;③中反应的离子方程式为__。
(3)四氯化碳在实验中所起的作用是__。
(4)该同学的实验设计不足之处是__,改进的办法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.5 mol钠、0.5 mol镁分别放入20 mL 1 mol·L-1的盐酸中,下列说法正确的是( )
A.钠与盐酸反应比镁剧烈B.镁与盐酸反应比钠剧烈
C.反应结束时钠、镁都有剩余D.反应结束时产生的气体一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
A.若该反应是放热反应,则a<0
B.用NO表示的平均化学反应速率v(NO)为0.16mol/(L·min)
C.达到化学平衡时,CO的转化率是80%
D.保持温度不变,若再向上述达到平衡的体系中充入2mol NO 和2mol CO,则反应重新达到平衡时c(N2)等于0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用NaOH溶液滴定X(NaH2PO4或NH4Cl)的稀溶液,溶液pH与n(NaOH)/n(X)的关系如图所示,已知:pKa=-lgKa,H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() 。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
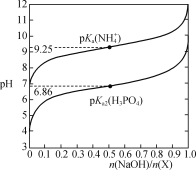
A.0.1mol·L-1NH4Cl溶液中滴加氨水至溶液呈中性:c(Cl-)=c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
B.0.1mol·L-1NaH2PO4溶液中滴加NaOH至溶液呈中性:c(Na+)>3c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
C.0.1mol·L-1NaH2PO4溶液中滴加K3PO4至溶液呈中性:c(K+)>c(Na+)
D.0.1mol·L-1NaH2PO4溶液中滴加氨水至溶液呈中性:c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )>2c(NH
)>2c(NH![]() )+2c(NH3·H2O)
)+2c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com