
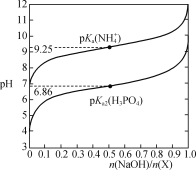
【题目】室温下,用NaOH溶液滴定X(NaH2PO4或NH4Cl)的稀溶液,溶液pH与n(NaOH)/n(X)的关系如图所示,已知:pKa=-lgKa,H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() 。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1NH4Cl溶液中滴加氨水至溶液呈中性:c(Cl-)=c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
B.0.1mol·L-1NaH2PO4溶液中滴加NaOH至溶液呈中性:c(Na+)>3c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
C.0.1mol·L-1NaH2PO4溶液中滴加K3PO4至溶液呈中性:c(K+)>c(Na+)
D.0.1mol·L-1NaH2PO4溶液中滴加氨水至溶液呈中性:c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )>2c(NH
)>2c(NH![]() )+2c(NH3·H2O)
)+2c(NH3·H2O)
【答案】AC
【解析】
溶液中性时,有![]() ,当
,当![]() 时,溶液呈碱性(pH=9.25);当
时,溶液呈碱性(pH=9.25);当![]() 时,溶液呈酸性(pH=6.86)。
时,溶液呈酸性(pH=6.86)。
A.0.1mol·L-1NH4Cl溶液中,由电荷守恒得:![]() ,溶液呈中性,即有
,溶液呈中性,即有![]() ,故
,故![]() 。
。![]() 水解显酸性,
水解显酸性,![]() 电离显碱性,由图像可知,
电离显碱性,由图像可知,![]() 时,即
时,即![]() 与
与![]() 为1:1时,溶液呈碱性(pH=9.25),故溶液中性时
为1:1时,溶液呈碱性(pH=9.25),故溶液中性时![]() ,A正确;
,A正确;
B.0.1mol·L-1NaH2PO4溶液中,由电荷守恒得:c(Na+)+c(H+)=![]() +
+![]() +
+![]() +c(OH-),溶液呈中性,即有
+c(OH-),溶液呈中性,即有![]() ,故c(Na+)=
,故c(Na+)=![]() +
+![]() +
+![]() ,图像可知,当
,图像可知,当![]() 时,即
时,即![]() 与
与![]() 为1:1时,溶液呈酸性(pH=6.86),若溶液呈中性,
为1:1时,溶液呈酸性(pH=6.86),若溶液呈中性,![]() 的量需要稍大,即有c(Na+)<3c(HP
的量需要稍大,即有c(Na+)<3c(HP![]() )+3c(P
)+3c(P![]() ),B错误;
),B错误;
C.当NaH2PO4与K3PO4为3:1时,溶液中![]() ,由于H2PO
,由于H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() ,此时溶液中
,此时溶液中![]() 与
与![]() 为1:1,由图像可知,此时的溶液呈酸性(pH=6.86),若溶液呈中性,K3PO4的量需稍微大一点,故c(K+)>c(Na+),C正确;
为1:1,由图像可知,此时的溶液呈酸性(pH=6.86),若溶液呈中性,K3PO4的量需稍微大一点,故c(K+)>c(Na+),C正确;
D.当NaH2PO4与氨水为1:2时,由物料守恒得c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )=2c(NH
)=2c(NH![]() )+2c(NH3·H2O) ,由图像可知
)+2c(NH3·H2O) ,由图像可知![]() ,所以
,所以![]() ,故
,故![]() 的酸性强于
的酸性强于![]() 的碱性,那么
的碱性,那么![]() 的酸性更强于
的酸性更强于![]() 的碱性,故
的碱性,故![]() 为酸性。NaH2PO4与氨水为1:2时,溶质为
为酸性。NaH2PO4与氨水为1:2时,溶质为![]() ,所以加的碱需要稍微多一点才能是中性,故c(H3PO4)+c(H2PO
,所以加的碱需要稍微多一点才能是中性,故c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )<2c(NH
)<2c(NH![]() )+2c(NH3·H2O),D错误;
)+2c(NH3·H2O),D错误;
故选AC。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
B.Fe(OH)2与足量稀硝酸反应:Fe(OH)2+2H+=Fe2++2H2O
C.Na2S碱性溶液中通入SO2生成Na2S2O3:3SO2+S2-=2S2O![]()
D.KMnO4酸性溶液与SO2反应:2MnO![]() +5SO2+4OH-=2Mn2++5SO
+5SO2+4OH-=2Mn2++5SO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解熔融氧化铝来制取金属铝,关于该反应的下列说法不正确的是
A.属于分解反应
B.属于氧化还原反应
C.金属铝是氧化产物
D.说明氧化铝是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0 平衡常数 K1
N2O2(g)(快) △H1<0 平衡常数 K1
②N2O2(g)+O2(g) ![]() 2NO2化) (慢) △H2<0 平衡常数K2
2NO2化) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 2NO(g) +O2(g)![]() 2NO2(g)的△H= -(△H1+△H2)
2NO2(g)的△H= -(△H1+△H2)
B. 2NO(g) +O2(g)![]() 2NO2 (g)的平衡常数 K =
2NO2 (g)的平衡常数 K =![]()
C. 反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用下图表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(![]() ),下列说法正确的是( )
),下列说法正确的是( )
A.与环戊醇互为同系物
B.分子中所有碳原子共平面
C.能使酸性高锰酸钾溶液和溴水褪色,且反应类型相同
D.可用碳酸钠溶液鉴别乙酸和M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
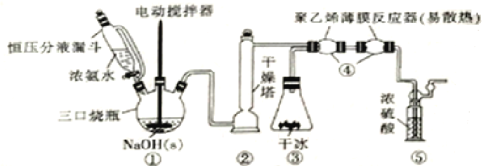
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com