
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
【答案】75% 18.75%
【解析】
(1)由于赤铁矿样品中其他成分不和酸反应也不溶于水,可判断恰好完全反应后过滤所得滤渣2.5g即赤铁矿样品中除氧化铁外的杂质;
(2)根据赤铁矿样品中氧化铁与稀硫酸反应的化学方程式,由参加反应的氧化铁的质量计算出恰好完全反应生成的硫酸铁的质量,利用质量守恒定律计算出反应后的溶液质量,利用溶液的溶质质量分数计算公式,计算出反应所得滤液中溶质的质量分数。
(1)10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g,则样品中氧化铁的质量=10g-2.50g=7.50g,赤铁矿样品中氧化铁的质量分数为:![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(2)根据铁守恒,Fe2O3的物质的量和Fe2(SO4)3的物质的量相等,所以所得滤液中硫酸铁的质量为![]() ×400g/mol=18.75g,反应所得滤液中溶质的质量分数为:
×400g/mol=18.75g,反应所得滤液中溶质的质量分数为:![]() ×100%=18.75%,故答案为:18.75%。
×100%=18.75%,故答案为:18.75%。


科目:高中化学 来源: 题型:
【题目】将0.5 mol钠、0.5 mol镁分别放入20 mL 1 mol·L-1的盐酸中,下列说法正确的是( )
A.钠与盐酸反应比镁剧烈B.镁与盐酸反应比钠剧烈
C.反应结束时钠、镁都有剩余D.反应结束时产生的气体一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用NaOH溶液滴定X(NaH2PO4或NH4Cl)的稀溶液,溶液pH与n(NaOH)/n(X)的关系如图所示,已知:pKa=-lgKa,H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() 。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
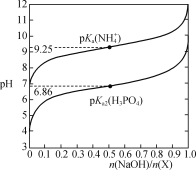
A.0.1mol·L-1NH4Cl溶液中滴加氨水至溶液呈中性:c(Cl-)=c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
B.0.1mol·L-1NaH2PO4溶液中滴加NaOH至溶液呈中性:c(Na+)>3c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
C.0.1mol·L-1NaH2PO4溶液中滴加K3PO4至溶液呈中性:c(K+)>c(Na+)
D.0.1mol·L-1NaH2PO4溶液中滴加氨水至溶液呈中性:c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )>2c(NH
)>2c(NH![]() )+2c(NH3·H2O)
)+2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质。
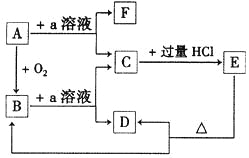
据此填写:
(1)B的化学式是____________,目前在现代通迅方面B已被用作_____________主要原料。
(2)B和a溶液反应的离子方程式是_____________________。
(3)A和a溶液反应的离子方程式是_____________________。
(4)C和过量盐酸反应的离子方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图所示的装置,对纯碱(碳酸钠)和小苏打(碳酸氢钠)两种固体进行实验探究:
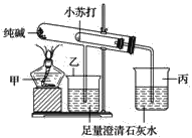
(1)写出甲、丙两种仪器的名称:______________,________________。
(2)在实验过程中,观察到丙仪器中的澄清石灰水变浑浊,请写出丙仪器中发生反应的化学方程式______________________。
(3)该实验探究利用的科学方法是__________________(填“控制变量法”、“对比观察法”或“定量分析法”),实验目的是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,硫被称为“生命元素”,它们形成的物质种类非常丰富,在生产、生活中用途广泛。
(1)基态S原子有___种能量不同的电子,其价电子排布图为___。
(2)硫能形成S2O![]() 、SO
、SO![]() 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O![]() 的空间构型为___,SO
的空间构型为___,SO![]() 的中心原子杂化方式为___。
的中心原子杂化方式为___。
(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的___区。
②SCN-的三种元素的电负性由大到小的顺序为___(用元素符号表示)。写出与SCN-互为等电子体的分子的分子式___(任写一种)。
③Fe(SCN)3中不存在的化学键有___(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.σ键 F.π键
(4)部分卤化铁的熔点如下表所示:
卤化铁 | FeF3 | FeCl3 |
熔点/℃ | 1100 | 306 |
解释表中物质之间熔点差异的原因___。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。
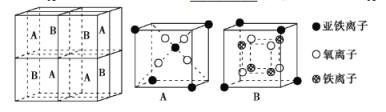
①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为___。
②己知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为___ nm(用含d和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com