
【题目】MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
【答案】D
【解析】
A.大气污染物主要是指二氧化硫,二氧化氮等氮硫氧化物,颗粒悬浮物等。空气成分中含有二氧化碳,不能把二氧化碳叫做大气污染物,只能说是造成温室效应的气体,故A错误;
B.根据图示,二氧化碳通过该电极转化为HCOOH,HCOOH中C元素的化合价为+2价,在转化过程中碳元素化合价由+4价变为+2价,化合价降低,得电子,发生还原反应,若该装置为电解池,则碳纳米棒作阴极,电解池的阴极与电源的负极相连,故B错误;
C.根据B项分析,二氧化碳在该电极上得电子,发生还原反应转化为HCOOH,故C错误;
D.不同的催化剂对反应的选择性不同,若选择使用其他催化剂导致二氧化碳生成HCOOH的选择性降低,可能得到HCHO或CH3OH等产物,故D正确;


科目:高中化学 来源: 题型:
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO、少量Pb。CuO和As2O3)制取高纯锌的工艺流程如图所示。
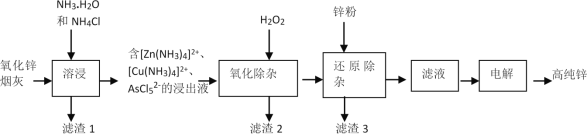
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的___性。
(2)“溶浸”时,氧化锌参与反应的相关离子方程式是____。
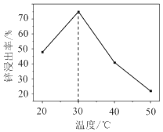
(3)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为___。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是____。
(5)“滤渣3”的主要成分为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
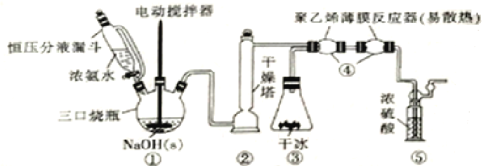
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制备高品质钴氧化物和单质钴粉的重要中间产品。用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)可以制备草酸钴晶体(CoC2O4·2H2O)。一种制备方法是选择草酸做沉淀剂,工业流程如图。
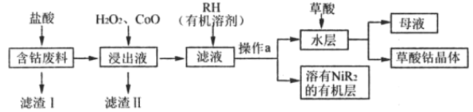
己知:①相关金属离子以氢氧化物形式沉淀完全的pH如下:
金属离子 | Fe3+ | Al3+ | Co2+ | Fe2+ | Ni2+ |
沉淀完全的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.5 |
②CoC2O4+2C2O![]()
![]() [Co(C2O4)3]4-。
[Co(C2O4)3]4-。
回答下列问题:
(1)CoC2O4中Co的化合价是___。
(2)浸出液中含有的阳离子除了H+、Co2+外,还有___。
(3)滤渣II的主要成分有___(填化学式)。
(4)加入RH的目的是___,操作a的名称是___。
(5)用一定浓度的草酸沉淀Co2+时,lg[Co]T,随溶液pH变化如图所示([Co]T表示Co以非沉淀形式存在的各种形态浓度之和)。
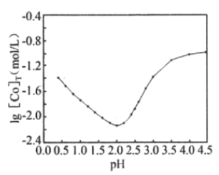
①沉淀Co2+时,应控制pH在___。
②lg[Co]T随pH的增大先减小后增大的原因为___。
(6)母液经氯气氧化后溶液中的盐酸可以循环使用,写出母液与氯气反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫脲[SC(NH2)2]别名硫代尿素,是一种白色固体,熔点182℃。硫脲可代替氰化物用于提炼金的新工艺。酸性条件下,硫脲在氧化剂(如Fe3+、H2O2、O2)存在下能溶解金,形成配离子Au[SC(NH2)2]![]() 。
。
回答下列问题:
(1)C、N、S三种元素中第一电离能最大的是___(填元素符号)。
(2)Au与Cu同族,价电子排布式为5d106s1,Au位于元素周期表的___区,Au+的价电子排布式为___。
(3)硫脲分子中碳原子的杂化方式为___,σ键和π键数目之比为___。
(4)写出硫脲在硫酸铁存在下溶解金的离子方程式___。
(5)硫脲加热到150℃时可转变成硫氰酸铵(NH4SCN),SCN-的空间构型为___形。
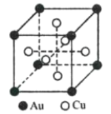
(6)一种铜金合金晶体具有面心立方最密堆积的结构,其晶胞如图所示,则该合金中Au原子与Cu原子个数之比为___。若铜和金的半径分别为apm和bpm,相对原子质量分别为MA和MB,阿伏加德罗常数的值为NA,计算晶体的密度为___g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com