
【题目】草酸钴是制备高品质钴氧化物和单质钴粉的重要中间产品。用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)可以制备草酸钴晶体(CoC2O4·2H2O)。一种制备方法是选择草酸做沉淀剂,工业流程如图。
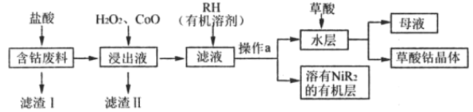
己知:①相关金属离子以氢氧化物形式沉淀完全的pH如下:
金属离子 | Fe3+ | Al3+ | Co2+ | Fe2+ | Ni2+ |
沉淀完全的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.5 |
②CoC2O4+2C2O![]()
![]() [Co(C2O4)3]4-。
[Co(C2O4)3]4-。
回答下列问题:
(1)CoC2O4中Co的化合价是___。
(2)浸出液中含有的阳离子除了H+、Co2+外,还有___。
(3)滤渣II的主要成分有___(填化学式)。
(4)加入RH的目的是___,操作a的名称是___。
(5)用一定浓度的草酸沉淀Co2+时,lg[Co]T,随溶液pH变化如图所示([Co]T表示Co以非沉淀形式存在的各种形态浓度之和)。
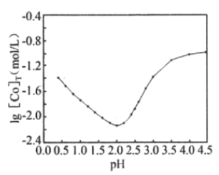
①沉淀Co2+时,应控制pH在___。
②lg[Co]T随pH的增大先减小后增大的原因为___。
(6)母液经氯气氧化后溶液中的盐酸可以循环使用,写出母液与氯气反应的化学方程式___。
【答案】+2 Fe2+、Ni2+、Al3+ Fe(OH)3、Al(OH)3 萃取Ni2+、与Co2+分离 分液 2.0 随pH增大,c(C2O![]() )增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O
)增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O![]() )增大,促进CoC2O
)增大,促进CoC2O![]() +2C2O
+2C2O![]()
![]() [Co(C4O4)3]4-正向进行,lg[Co2+]T增大 Cl2+H2C2O4=2CO2+2HCl
[Co(C4O4)3]4-正向进行,lg[Co2+]T增大 Cl2+H2C2O4=2CO2+2HCl
【解析】
含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)加入盐酸后,Co 、Ni、Al2O3、Fe与盐酸反应生成Co2+、Ni2+、Fe2+、Al3+,SiO2不与盐酸反应故滤渣I为SiO2;向浸出液中加入过氧化氢和氧化钴,氧化亚铁离子并调节pH,使Fe(OH)3、Al(OH)3以沉淀形式析出;再加入RH,生成溶于有机物的NiR2,分液后再加入草酸经操作生成草酸钴晶体。
(1)草酸根离子为-2价,故CoC2O4中Co的化合价为+2价;
(2)综上分析,浸出液中含有的阳离子除了H+、Co2+外,还有反应生成的、Ni2+、Fe2+、Al3+;
(3)因亚铁离子完全沉淀的pH大于钴离子,为防止钴离子的损失,加入过氧化氢氧化亚铁离子,使亚铁离子转化为铁离子,再加入氧化钴,调节pH,使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀而除去;
(4)滤液中含有Co2+、Ni2+,为了除去镍离子得到纯净的钴离子,故加入RH生成溶于有机物的NiR2而使Ni2+与Co2+分离;操作a将有机相和水相分离,操作名称为分液;
(5) ①根据图像可知,为了尽可能生成草酸钴沉淀,则o以非沉淀形式存在的各种形态浓度之和应尽可能得小,故pH应控制在2.0;
②用一定浓度的草酸沉淀Co2+,随pH增大,c(C2O![]() )增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O
)增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O![]() )增大,促进CoC2O
)增大,促进CoC2O![]() +2C2O
+2C2O![]()
![]() [Co(C4O4)3]4-正向进行,lg[Co2+]T增大;
[Co(C4O4)3]4-正向进行,lg[Co2+]T增大;
(6)母液中主要成分为草酸,草酸与氯气发生氧化还原反应生成二氧化碳和氯化氢,反应方程式为Cl2+H2C2O4=2CO2+2HCl。


科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
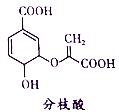
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加 | 有气体生成,溶液呈血红色 | 稀硝酸将 |
B | 将铜粉加 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
C |
| 溶液变红 |
质 |
D | 取少量绿矾 | 溶液未变红色 | 绿矾未因氧化而变质 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环中不存在碳碳单键和碳碳双键交替的结构,可以作为证据的事实是( )
①苯是无色易挥发的液体;
②苯不能使酸性高锰酸钾溶液褪色;
③![]() 和
和 是同一种物质。
是同一种物质。
A. ①②③ B. ①和② C. ①和③ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品,实验室用硝酸氧化淀粉液水解制取草酸的装置如图所示(加热搅拌和仪器固定装置已略去)。
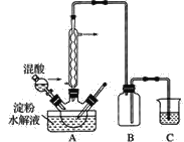
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO2与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却、抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+2HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
回答下列问题:
(1)检验淀粉是否水解完全所需用的试剂为__。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_。
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO全部吸收,原因是__(用化学方程式表示)。
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是什么?__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:
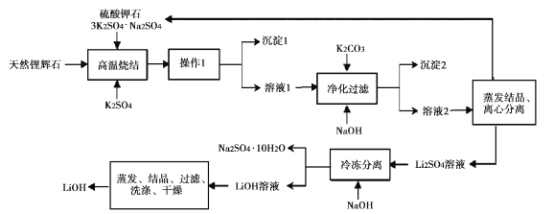
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
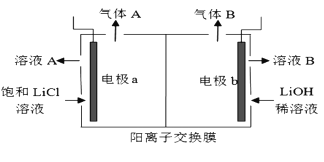
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com