
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
【答案】C
【解析】
A、分析莽草酸的结构简式可知其分子式为:C7H10O5,A错误;
B、其分子中含有羧基、碳碳双键和醇羟基三种官能团,B错误;
C、其结构中的碳碳双键能发生加成反应、羧基和醇羟基均发生酯化反应和取代反应,C正确;
D、莽草酸中的羟基是醇羟基,其不能在水溶液中电离出氢离子,D错误。答案选C。
类别 | 脂肪醇 | 芳香醇 | 酚 |
官能团 | 醇羟基 | 醇羟基 | 酚羟基 |
结构特点 | -OH与链烃基相连 | -OH与苯环上的侧链相连 | -OH与苯环直接相连 |
羟基上H的活泼性 | 能与金属钠反应,但比水弱,不能与NaOH、Na2CO3溶液反应 | 有弱酸性,能与NaOH、Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
原因 | 烃基对羟基的影响不同,烷基使羟基上H的活泼性减弱,苯基使羟基上H的活泼性增强 | ||


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:

已知:①Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4![]() 10-11
10-11
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mgL-1。残液中残留的Ca2+浓度至少应为_____mgL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
C. 在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆
D. 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
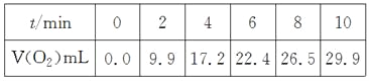
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 6~10 min的平衡反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应到6 min时,c(H2O2)=0.30 mol·L-1
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法错误的是
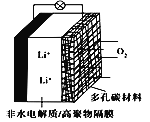
A. 放电时,多孔碳材料电极为正极
B. 放电时,外电路电子由锂电极流向多孔碳材料电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-0.5 x)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。

(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。

该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com