
����Ŀ����һ���¶��£�10 mL 0.40 mol��L��1H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�����(������Ϊ��״��)���±���
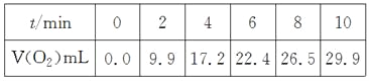
������������ȷ����(��Һ����仯���Բ���)(����)
A. 0��6 min��ƽ�ⷴӦ���ʣ�v(H2O2)��3.3��10��2mol��L��1��min��1
B. 6��10 min��ƽ�ⷴӦ���ʣ�v(H2O2)<3.3��10��2mol��L��1��min��1
C. ��Ӧ��6 minʱ��c(H2O2)��0.30 mol��L��1
D. ��Ӧ��6 minʱ��H2O2�ֽ���50%
���𰸡�C
��������
A��0��6minʱ���ڣ���������Ϊ0.0224L/22.4L��mol��1=0.001mol������c��H2O2��=0.002mol��0.01L=0.2mol��L��1������v=��c/��t����v��H2O2����
B�����ŷ�Ӧ�Ľ��У�H2O2��Ũ����С����Ӧ���ʼ�����С��0��6minʱ���ڷ�Ӧ���ʣ�
C����A�����֪6min�ڹ�������Ũ�ȱ仯����6minʱ��Ũ��=��ʼŨ��-Ũ�ȱ仯����
D��H2O2�ֽ���=��H2O2Ũ�ȱ仯����H2O2��ʼŨ�ȣ���100%��
A��aA��bB===cC��dD��v(A)��![]() ��0��6 min��v(O2)��22.4 mL��n(O2)��0.001 mol���ֽ��H2O2Ϊ0.002 mol����c(H2O2)��0.002 mol��0.01 L��0.20 mol��L��1��v(H2O2)��0.2 mol��L��1��6 min��3.3��10��2mol��L��1��min��1����A��ȷ��
��0��6 min��v(O2)��22.4 mL��n(O2)��0.001 mol���ֽ��H2O2Ϊ0.002 mol����c(H2O2)��0.002 mol��0.01 L��0.20 mol��L��1��v(H2O2)��0.2 mol��L��1��6 min��3.3��10��2mol��L��1��min��1����A��ȷ��
B�����ŷ�Ӧ�Ľ��з�Ӧ��Ũ����С����Ӧ���ʻ������6��10 min��ƽ����Ӧ���ʣ�v(H2O2)<3.3��10��2mol��L��1��min��1����B��ȷ��
C��6 minʱ��c(H2O2)��0.40 mol��L��1��0.20 mol��L��1��0.20 mol��L��1����C����
D��6 minʱ��H2O2�ֽ��ʣ�![]() ��50%����D��ȷ��
��50%����D��ȷ��
��ѡC��


 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���Ԫ�ر���������
A. FeS+2HCl��FeCl2+H2S�� B. Fe+H2S04��FeS04+H2��
C. FeO+2HCl��FeCl2+H20 D. Fe203+3CO![]() 2Fe+3C02
2Fe+3C02
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�ù㷺�Ľ���������������Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ�����һ�ֹ����������£�

ע��SiO2����������ʱת��Ϊ�������Ƴ�����
��1����������ʱ����ƫ�����Ƶ����ӷ���ʽΪ_________________________��
��2���������ˢ���������Һ�м���NaHCO3��Һ����Һ��pH________������������䡱��С������
��3�����������ǵ������ Al2O3������������������ʯī�����ģ�ԭ����____________________�������ĵ缫��ӦʽΪ_____________________��
��4������������ǵ��Na2CO3��Һ��ԭ����ͼ��ʾ��

�����ĵ缫��ӦʽΪ________________����������Һ��pH�仯________���������䡢��С��
��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç��������ںϳ�ҩ���ƣ���ṹ��ʽ��ͼ�����й���ç�����˵����ȷ����

A.����ʽΪC7H6O5
B.�����к���2�ֹ�����
C.�ɷ����ӳɺ�ȡ����Ӧ
D.��ˮ��Һ�Ȼ����ǻ����ܵ����H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����Ũ����ˮΪԭ����ȡ��IJ�����������ͼ������˵����ȷ����

A. ��ˮ��ҪŨ��������Ϊ��ˮ�е�Br2�����ϵ�
B. �ȿ����������ǽ������Cl2����
C. �������з����ķ�Ӧ��3Br2+3CO32��=5Br-+BrO3��+3CO2��
D. ��Ӧ��2�з����ķ�Ӧ��5Br-+BrO3��+3H2O=3Br2+6OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ����õع����Ʊ��Ҵ����Ҵ��ټӹ��Ʊ����ֻ������ϡ�

(1)A�Ľṹ��ʽΪ_____________________________��
(2)����ӦI����������__________________________��
(3)B�Ĺ���������Ϊ______________________��
(4)ʵ���Һϳɲ���������IJ���Ϊ:��ͼ����a�м���10.6g��ˮ�Ҵ���9.0g��ˮ���ᡢ��ˮ���ױ�������TsOH(�л���)��2~3Ƭ���Ƭ����74~76���ַ�Ӧ��a�����û��Һ��ȴ��������ˮ������̼������Һϴ�ӣ�������ˮ�����Ƹ����ѹ���õ����������12.8g��

��������������____�����Ƭ��������____________________________��
�ںϳɹ�������ʵļ��ȷ�ʽ��__________��
a.�ƾ���ֱ�Ӽ��� b.��ԡ C.ˮԡ d.ɰԡ
�۱���̼������Һ��������__________________________��
�ܺϳɲ���������Ļ�ѧ����ʽΪ______________________________��
�ݲ���������IJ���Ϊ____________________(����С�����һ-λ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��P4(g)��6Cl2(g)===4PCl3(g) ��H��a kJ��mol��1��
P4(g)��10Cl2(g)===4PCl5(g) ��H��b kJ��mol��1��
��֪�γɻ��1 mol��ѧ���ų������յ�������Ϊ�û�ѧ���ļ��ܡ�P4������������ṹ��PCl5��P��Cl���ļ���Ϊc kJ��mol��1��PCl3��P��Cl���ļ���Ϊ1.2c kJ��mol��1������������ȷ����
A. P��P���ļ��ܴ���P��Cl���ļ���
B. ����Cl2(g)��PCl3(g)===PCl5(s)�ķ�Ӧ����H
C. Cl��Cl���ļ���Ϊ(b��a��5.6c)/4 kJ��mol��1
D. P��P���ļ���Ϊ(5a��3b��12c)/8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ1gO2��1gX��������ͬ�ݻ����ܱ�������ѹǿ(p)���¶�(T)�Ĺ�ϵ����X��������ǣ� ��

A. C2H4B. CH4C. CO2D. NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȼ�����ɽ�������̼��Ϊȼ�ϡ��ش��������⣺

(��֪����ı�ȼ������H����890 kJ��mol��1) ��
(1)��ѧ���õ����ز�����ͭ��װ��ͼ��ʾ���˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4��
��д��ͭ�缫����ĵ缫��Ӧʽ��_________________________��
�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ��___________________________��
(2)����CO2��H2��Ӧ���Ʊ�CH4��
��֪�����ı�ȼ������H����286 kJ��mol��1 ��H2O(g) = H2O (l)����H����44kJ��mol��1��
�������̼��������Ӧ���ɼ����ˮ�������Ȼ�ѧ����ʽΪ_____________________��
�÷�Ӧ���Է���������__________(����»����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com