
【题目】工业上可利用地沟油制备乙醇,乙醇再加工制备多种化工材料。

(1)A的结构简式为_____________________________。
(2)“反应I”的现象是__________________________。
(3)B的官能团名称为______________________。
(4)实验室合成草酸二乙酯的步骤为:如图,在a中加入10.6g无水乙醇、9.0g无水草酸、脱水剂甲苯、催化剂TsOH(有机酸)和2~3片碎瓷片,在74~76℃充分反应。a中所得混合液冷却后依饮用水、饱和碳酸钠溶液洗涤,再用无水硫酸钠干燥。减压蒸馏,得到草酸二乙酯12.8g。

①仪器的名称是____,碎瓷片的作用是____________________________。
②合成过程最合适的加热方式是__________。
a.酒精灯直接加热 b.油浴 C.水浴 d.砂浴
③饱和碳酸钠溶液的作用是__________________________。
④合成草酸二乙酯的化学方程式为______________________________。
⑤草酸二乙酯的产率为____________________(保留小数点后一-位)。
【答案】CH2Br-CH2Br 溴水颜色变浅(或退色)醛基圆底烧瓶防止暴沸C除去草酸、有机酸,溶解乙醇;降低酯的溶解度![]() 87.7%
87.7%
【解析】
本题考查的是有机物的合成,掌握有机物的性质是关键。
(1)乙烯和溴水反应生成A,结构简式为CH2Br-CH2Br; (2) “反应I”的现象为溴水颜色变浅(或退色);(3)乙二醛的官能团为醛基; (4) ① 仪器a为圆底烧瓶;加入碎瓷片的作用是防止暴沸;②因为要控制温度范围,所以最好用水浴加热,选C;③乙醇能溶解在饱和碳酸钠溶液中,而酯的溶解度会降低,饱和碳酸钠能反应酸,作用为除去草酸、有机酸,溶解乙醇;降低酯的溶解度;④草酸和乙醇反应生成草酸二乙酯和水,方程式为: ![]() ;⑤乙醇的质量为10.6克,草酸的质量为9.0克,根据反应方程式分析,乙醇过量,用草酸进行计算,理论上生成14.6克草酸二乙酯,则产率为12.8/14.6= 87.7%。
;⑤乙醇的质量为10.6克,草酸的质量为9.0克,根据反应方程式分析,乙醇过量,用草酸进行计算,理论上生成14.6克草酸二乙酯,则产率为12.8/14.6= 87.7%。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.100molL﹣1稀盐酸和0.100molL﹣1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100molL﹣1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100molL﹣1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:(填序号).
(2)测定过程中发生反应的离子方程式为: .
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为 , 理由是 .
(4)某同学四次测定的V数据如表:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数 .
(5)下列实验操作会引起测量结果偏低的是 .
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) = 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=(只需代入数据,不用计算结果)
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式: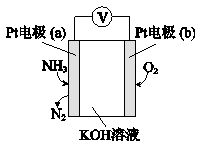
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面两种气体的原子数一定相等的是( )
A.质量相等,密度不同的氮气和一氧化碳
B.体积相等,密度相等的氮气和氢气
C.在温度相同、体积相等的条件下氧气和氮气
D.在压强相同、体积相等的条件下氧气和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:
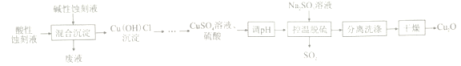
已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______左右。
pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
废液含铜量/g.L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17.0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成Cu2O的离子方程式为_________;该过程产生的SO2经_____(填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:
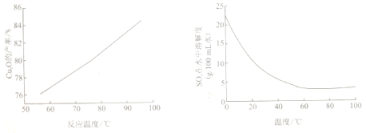
下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120g·L-1的酸性蚀刻液和V2L含铜量160g·L-1的碱性蚀刻液制备Cu2O,最终得到产品mg,产率为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,下列除杂![]() 括号内物质为杂质
括号内物质为杂质![]() 的方法正确的是
的方法正确的是![]()
![]()
A. 溴苯(溴):加入KI溶液,振荡,分液
B. 乙烷(乙烯):通过盛有![]() 溶液的洗气瓶
溶液的洗气瓶
C. 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液
D. 乙烯(SO2):通过盛有溴水的洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A. 1mol苯分子中含有C=C双键数目为3NA
B. 标准状况下,11.2LCCl4中含有的共价键数目为2NA
C. 1mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA
D. 常温常压下,17g羟基含有的电子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2 , 在相同温度下发生反应:2SO2+ O2 ![]() 2SO3 , 并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3 , 并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A.等于p%
B.大于p%
C.小于p%
D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com