
����Ŀ��ij��θҩ��ֹ���Ϊ̼��ƣ��ⶨÿƬ��̼��ƺ����ķ��������¼�����������ҩƬ�е������ɷֲ���������������Ʒ�Ӧ����
������0.100molL��1ϡ�����0.100molL��1����������Һ��
��ȡһ��ҩƬ��ҩƬ������ͬ����Ϊ0.100g������������20.0mL����ˮ
���Է�̪Ϊָʾ������0.100molL��1����������Һ�ζ�����ȥ���ΪVʱ�ﵽ�յ�
�ܼ���25.00mL 0.100molL��1ϡ���ᣮ
��ش���������
��1���ⶨ���̵���ȷ����˳��Ϊ��������ţ���
��2���ⶨ�����з�����Ӧ�����ӷ���ʽΪ�� ��
��3����ij��ʵ�����ظ��ⶨ4�Σ�ʵ��������50mL��100mL��250mL��500mL���ֹ�������ƿ��������ϡ����Ӧѡ�õ�����ƿ������Ϊ �� ������ ��
��4��ijͬѧ�Ĵβⶨ��V���������
�ⶨ���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
�������λͬѧ��ʵ�����ݣ�����ҩƬ��̼��Ƶ��������� ��
��5������ʵ�����������������ƫ�͵��� ��
������ƽ����NaOH���壬��С�ձ��������̣�����������̣����ƶ����룬ʹ֮ƽ�⣮
�ڵζ�ǰ�ζ��ܼ��������ݣ��ζ������������ʧ ���к͵ζ�ʱ����ƿ������������ˮ���ܵζ���������ˮϴ��δ�ñ�Һϴ�� �ݶ�ȡ�ζ����յ����ʱ�����ӿ̶��ߣ�
���𰸡�
��1���٢ڢܢۻ�ڢ٢ܢ�
��2��CaCO3+2H+=Ca2++CO2��+H2O������H++OH��=H2O
��3��250mL,4����100 mL,��ʵ���������������ϴ�ζ��ܡ���Һ�桢�����ݵ�����HCl,��������Ҫ����100 mL
��4��60.0%
��5���٢ڢܢ�
���������⣺��1������ʵ�鲽������жϲ���˳��������Һ���ܽ���Ʒ���������ƵĹ���������Һ�ܽ�̼��ƣ�ʣ�������������������Һ�ζ������㷴Ӧ�����ᣬͨ��̼��ƺ����ᷴӦ������ϵ���㺬�����ⶨ���̵���ȷ����˳��Ϊ�٢ڢܢۻ�ڢ٢ܢۣ�
���Դ��ǣ��٢ڢܢۻ�ڢ٢ܢۣ�
��2�������з����ķ�ӦΪ̼��ƺ��������������Ȼ��ơ�������̼��ˮ����Ӧ�����ӷ���ʽΪ��CaCO3+2H+=Ca2++CO2��+H2O������������Һ�����ᷴӦ�����Ȼ��ƺ�ˮ����Ӧ�����ӷ���ʽΪ��H++OH��=H2O��
���Դ��ǣ�CaCO3+2H+=Ca2++CO2��+H2O��H++OH��=H2O��
��3��ÿ��ȡ��25.00 mL���ᣬ4����100 mL����ʵ���������������ϴ�ζ��ܡ���Һ�桢�����ݵ�����HCl����������Ҫ����100 mL��ѡ������ƿ250mL��
���Դ��ǣ�250mL��4����100 mL����ʵ���������������ϴ�ζ��ܡ���Һ�桢�����ݵ�����HCl����������Ҫ����100 mL��
��4���ڶ����������ϴ�Ӧ��ʡȥ������ÿƬҩ��ƽ����NaOH��Һ���Ϊ ![]() =13.0 mL����CaCO3��Ӧ����������Ϊ��25.0 mL��13.0 mL=12.0 mL����ÿƬҩ����CaCO3����������
=13.0 mL����CaCO3��Ӧ����������Ϊ��25.0 mL��13.0 mL=12.0 mL����ÿƬҩ����CaCO3���������� ![]() ��100%=60.0%
��100%=60.0%
���Դ��ǣ�60.0%��
��5����ʹ����ƽʱ�����������ֵ��ʵ��ֵƫС���������������ҺŨ��ƫ�ͣ��ζ����V���ƫ����V���ᣩ= ![]() ����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
�ڵζ�ǰ�ζ��ܼ��������ݣ��ζ������������ʧ�������V���ƫ����V���ᣩ= ![]() ����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
���к͵ζ�ʱ����ƿ������������ˮ���Խ����Ӱ�죬�ʢ۴���
�ܵζ���������ˮϴ��δ�ñ�Һϴ�����������Ʊ�ϡ�ͣ����V���ƫ����V���ᣩ= ![]() ����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
�����ӿ̶��������ƫ�����V���ƫ����V���ᣩ= ![]() ����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
����֪V���ᣩƫ������CaCO3��Ӧ����������=25ml��V�����ᣩƫС������������ƫ�ͣ��ʢ���ȷ��
��ѡ���٢ڢܢݣ�


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ= ��
��2���÷�ӦΪ��Ӧ��ѡ�����ȡ����ȣ���
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O�������жϴ�ʱ���¶�Ϊ�森
��4����1200��ʱ����ijʱ��ƽ����ϵ��CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2molL��1��
2molL��1��4molL��1��4molL��1 �� ���ʱ������Ӧ��ƽ���ƶ�����Ϊ �� ��ѡ�����Ӧ�������淴Ӧ���������ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۼ��������������Ӽ��ͷ��Ӽ����������ǹ�����������IJ�ͬ������������к�������������������ľ�����(����)
A. ̼���辧�� B. Ar����
C. NaCl���� D. NaOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL��������������ȷ���ǣ�������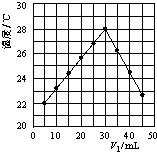
A.����ʵ��ʱ�����¶�Ϊ22��
B.��ʵ�������ѧ�ܿ���ת��Ϊ����
C.NaOH��Һ��Ũ��Լ��1.00 mol/L
D.��ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йس�����pH��Ϊ3�Ĵ���������˵����ȷ���ǣ�������
A.������Һ�У���ˮ�������������Ũ�Ⱦ�Ϊ1��10��11 molL��1
B.�ֱ��ˮϡ��100����������Һ��pH����ͬ
C.�����е�c��CH3COO�����������е�c��SO42�������
D.�ֱ��������пƬ��������Һ����H2�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����AlCl3Ϊ���ۻ�����������Al��Cl����ļн�Ϊ120�����ɴ˿ɼ���AlCl3���� (����)
A. �ɼ��Լ��γɵļ��Է���
B. �ɼ��Լ��γɵķǼ��Է���
C. �ɷǼ��Լ��γɵļ��Է���
D. �ɷǼ��Լ��γɵķǼ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ����������ҵ��뵼����ϵĺ���λ���ǣ� ��
A.����Ԫ�غͷǽ���Ԫ�ؽ��紦
B.����Ԫ����
C.���ڱ����Ͻ�
D.���ڱ����½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ��ȡ7.6g����ͭ������500ml��ˮ�� B. ��ȡ8.0g����ͭ����ˮ500ml�����Һ��
C. ��ȡ12.0g���������500ml��Һ�� D. ��ȡ12.5g���������500ml��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ����õع����Ʊ��Ҵ����Ҵ��ټӹ��Ʊ����ֻ������ϡ�

(1)A�Ľṹ��ʽΪ_____________________________��
(2)����ӦI����������__________________________��
(3)B�Ĺ���������Ϊ______________________��
(4)ʵ���Һϳɲ���������IJ���Ϊ:��ͼ����a�м���10.6g��ˮ�Ҵ���9.0g��ˮ���ᡢ��ˮ���ױ�������TsOH(�л���)��2~3Ƭ���Ƭ����74~76���ַ�Ӧ��a�����û��Һ��ȴ��������ˮ������̼������Һϴ�ӣ�������ˮ�����Ƹ����ѹ���õ����������12.8g��

��������������____�����Ƭ��������____________________________��
�ںϳɹ�������ʵļ��ȷ�ʽ��__________��
a.�ƾ���ֱ�Ӽ��� b.��ԡ C.ˮԡ d.ɰԡ
�۱���̼������Һ��������__________________________��
�ܺϳɲ���������Ļ�ѧ����ʽΪ______________________________��
�ݲ���������IJ���Ϊ____________________(����С�����һ-λ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com