
【题目】在元素周期表中最容易找到半导体材料的合理位置是( )
A.金属元素和非金属元素交界处
B.过渡元素区
C.周期表右上角
D.周期表左下角
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
① Q为元素周期表中原子半径最小的元素;
② R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③ Y的基态原子的核外成对电子数是未成对电子数的3倍;
④ Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为____________,其中心原子采取_______杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为____。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________________。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为_____(写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,该反应的离子方程式为_________________________。
(5)某含Z配合物,化学式为[ZCl(H2O)5]Cl2, 配位数为____,1 mol该配合物中![]() 键的数目为___。
键的数目为___。
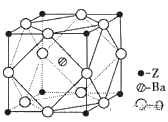
(6)Z原子基态时的价电子排布式为__________;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶体中氧原子与钡原子的最近距离为_______cm。(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
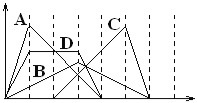
A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.100molL﹣1稀盐酸和0.100molL﹣1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100molL﹣1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100molL﹣1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:(填序号).
(2)测定过程中发生反应的离子方程式为: .
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为 , 理由是 .
(4)某同学四次测定的V数据如表:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数 .
(5)下列实验操作会引起测量结果偏低的是 .
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是
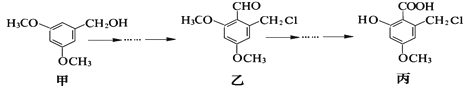
A. 乙、丙都能发生银镜反应
B. 用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 甲、乙、丙三种有机化合物均可与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铁粉制备摩尔盐的操作流程如下:
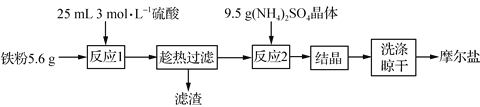
(1)流程中“趁热”过滤的原因是__________。
(2) 反应1制得硫酸亚铁的物质的量理论上应小于__________mol。
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704 g新制摩尔盐,溶于水配制成100.0 mL溶液,再将该溶液分成两等份。
向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸
变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796 g。
另一份溶液用0.050 0 mol·L-1 K2Cr2O7酸性溶液滴定,当Cr2O![]() 恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO![]() 离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
②确定该摩尔盐的化学式(写出计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表述正确的是( )
A. 核内质子数为117,核内中子数为174的核素Ts可表示为:174TS
B. 乙醇的结构简式:C2H6O
C. COCl2 的结构式为: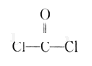
D. CaO2的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) = 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=(只需代入数据,不用计算结果)
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式: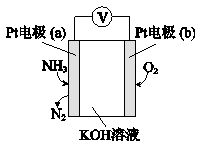
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com