
【题目】如图表示1gO2与1gX气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )

A. C2H4B. CH4C. CO2D. NO
【答案】C
【解析】
恒温恒容时,气体压强与物质的量成正比,由图象可知,相同温度下,等质量的氧气压强大于X气体,说明等质量气体中,氧气的物质的量较大,根据n=m/M可知质量相同时,物质的量与摩尔质量成反比,则氧气的摩尔质量小于X。
恒温恒容时,气体压强与物质的量成正比,由图象可知,相同温度下,等质量的氧气压强大于X气体,说明等质量的气体中,氧气的物质的量较大,根据n=m/M可知质量相同时,物质的量与摩尔质量成反比,则氧气的摩尔质量小于X,氧气的摩尔质量为32g/mol;
A项,C2H4的摩尔质量等于28g/mol,小于32g/mol,故不选A项;
B项,CH4的摩尔质量等于16g/mol,小于32g/mol,故不选B项;
C项,CO2的摩尔质量等于44g/mol,大于32g/mol,故选C项;
D项,NO的摩尔质量等于30g/mol,小于32g/mol,故不选D项。
答案选C。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:

已知:①Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4![]() 10-11
10-11
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mgL-1。残液中残留的Ca2+浓度至少应为_____mgL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
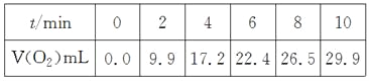
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 6~10 min的平衡反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应到6 min时,c(H2O2)=0.30 mol·L-1
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法错误的是
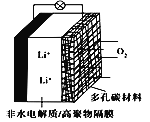
A. 放电时,多孔碳材料电极为正极
B. 放电时,外电路电子由锂电极流向多孔碳材料电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-0.5 x)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是m g,一个12C的原子质量是n g,NA是阿伏加德罗常数的值,下列说法错误的是
A.该原子的摩尔质量是mNA g/mol
B.w g该原子的物质的量一定是![]() mol
mol
C.w g该原子中含有![]() ×NA个该原子
×NA个该原子
D.由已知信息可得:NA=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。

(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。

该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是_____;
(4)标准状况下某种O2和N2的混合气体m g,含有b个分子,则n g该混合气体在相同状况下所占的体积应是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com