
【题目】草酸是一种重要的化工产品,实验室用硝酸氧化淀粉液水解制取草酸的装置如图所示(加热搅拌和仪器固定装置已略去)。
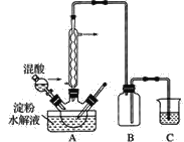
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO2与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却、抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+2HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
回答下列问题:
(1)检验淀粉是否水解完全所需用的试剂为__。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_。
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO全部吸收,原因是__(用化学方程式表示)。
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是什么?__、__。
【答案】碘水 温度过高、硝酸浓度过大,会导致C6H12O6和H2C2O4进一步被氧化 NO2+NO+2NaOH=2NaNO2+H2O 优点:提高HNO3利用率 缺点:NO吸收不完全
【解析】
(1)碘水遇到淀粉会变蓝,如果溶液中加入碘水没有变化,则说明水解完全,无淀粉;
(2)草酸具有还原性,硝酸能进一步氧化H2C2O4;
(3)氢氧化钠溶液吸收NO和NO2发生的反应为归中反应,反应方程为NO+NO2+2NaOH=2NaNO2+H2O;
(4)根据尾气的成分和氢氧化钠和淀粉的性质解答;据此解答。
(1)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解;若不显蓝色,则证明淀粉完全水解;故答案为:碘水;
(2)混酸为65%NHO3与98%H2SO4的混合液,混合液溶于水放热,温度高能加快化学反应,硝酸能进一步氧化H2C2O4,生成二氧化碳;故答案为:温度过高、硝酸浓度过大,会导致C6H12O6和H2C2O4进一步被氧化;
(3)氢氧化钠溶液吸收NO和NO2发生的反应为归中反应,反应方程为NO+NO2+2NaOH=2NaNO2+H2O,由方程式的系数可知,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO全部吸收;故答案为:NO2+NO+2NaOH=2NaNO2+H2O;
(4)尾气为一氧化氮和二氧化氮,用碱吸收,它们将转变为亚硝酸钠,被完全吸收,如果用淀粉水解液吸收,葡萄糖能继续被硝酸氧化,但NO吸收不完全;故答案为:优点:提高HNO3利用率;缺点:NO吸收不完全。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】中和热的测定实验中取![]() 的NaOH溶液50mL与
的NaOH溶液50mL与![]() 的硫酸50mL置于下图所示的装置中,进行中和热的测定实验,回答下列问题:
的硫酸50mL置于下图所示的装置中,进行中和热的测定实验,回答下列问题:
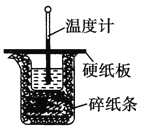
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 ______ ;
(2)大烧杯上如不盖硬纸板,求得的中和热数值____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() ;
;
(3)若![]() 溶液和
溶液和![]() 硫酸溶液的密度都是
硫酸溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,通过以下数据计算中和热
,通过以下数据计算中和热![]() _______
_______![]() 结果保留小数点后一位
结果保留小数点后一位![]() 。
。
温度实验次数 | 起始温度 | 终止温度 | ||
| NaOH | 平均值 | ||
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
(4)如果用![]() 盐酸与
盐酸与![]() 溶液进行反应,与上述实验相比,所放出的热量____
溶液进行反应,与上述实验相比,所放出的热量____![]() 填“相等、不相等”
填“相等、不相等”![]() ,所求中和热____
,所求中和热____![]() 填“相等、不相等”
填“相等、不相等”![]() 。
。
(5)用相同浓度和体积的氨水![]() 代替NaOH溶液进行上述实验,测得的中和热的数值会____。
代替NaOH溶液进行上述实验,测得的中和热的数值会____。![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制备高品质钴氧化物和单质钴粉的重要中间产品。用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)可以制备草酸钴晶体(CoC2O4·2H2O)。一种制备方法是选择草酸做沉淀剂,工业流程如图。
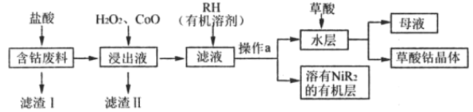
己知:①相关金属离子以氢氧化物形式沉淀完全的pH如下:
金属离子 | Fe3+ | Al3+ | Co2+ | Fe2+ | Ni2+ |
沉淀完全的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.5 |
②CoC2O4+2C2O![]()
![]() [Co(C2O4)3]4-。
[Co(C2O4)3]4-。
回答下列问题:
(1)CoC2O4中Co的化合价是___。
(2)浸出液中含有的阳离子除了H+、Co2+外,还有___。
(3)滤渣II的主要成分有___(填化学式)。
(4)加入RH的目的是___,操作a的名称是___。
(5)用一定浓度的草酸沉淀Co2+时,lg[Co]T,随溶液pH变化如图所示([Co]T表示Co以非沉淀形式存在的各种形态浓度之和)。
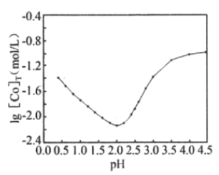
①沉淀Co2+时,应控制pH在___。
②lg[Co]T随pH的增大先减小后增大的原因为___。
(6)母液经氯气氧化后溶液中的盐酸可以循环使用,写出母液与氯气反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫脲[SC(NH2)2]别名硫代尿素,是一种白色固体,熔点182℃。硫脲可代替氰化物用于提炼金的新工艺。酸性条件下,硫脲在氧化剂(如Fe3+、H2O2、O2)存在下能溶解金,形成配离子Au[SC(NH2)2]![]() 。
。
回答下列问题:
(1)C、N、S三种元素中第一电离能最大的是___(填元素符号)。
(2)Au与Cu同族,价电子排布式为5d106s1,Au位于元素周期表的___区,Au+的价电子排布式为___。
(3)硫脲分子中碳原子的杂化方式为___,σ键和π键数目之比为___。
(4)写出硫脲在硫酸铁存在下溶解金的离子方程式___。
(5)硫脲加热到150℃时可转变成硫氰酸铵(NH4SCN),SCN-的空间构型为___形。
(6)一种铜金合金晶体具有面心立方最密堆积的结构,其晶胞如图所示,则该合金中Au原子与Cu原子个数之比为___。若铜和金的半径分别为apm和bpm,相对原子质量分别为MA和MB,阿伏加德罗常数的值为NA,计算晶体的密度为___g/cm3。
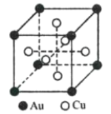
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时10mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了35mL,剩余气体再通过氢氧化钠溶液,体积又减少了40mL。
(1)气态烃的分子式是__。
(2)写出该气态烃所有同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
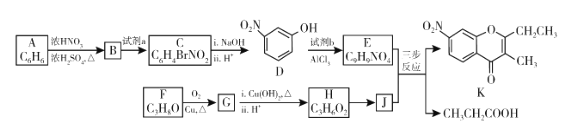
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如下:
已知:
①
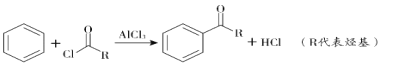
②
![]()
③
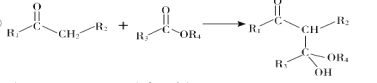
(![]() 代表烃基)
代表烃基)
(1)A的结构简式是_________;根据系统命名法,F的名称是__________。
(2)B→C所需试剂a是__________;试剂b的结构简式是_________。
(3)C与足量的![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(4)G与新制![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(5)已知:①![]() ;②J分子中有两种化学环境不同的氢以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:__________
;②J分子中有两种化学环境不同的氢以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:__________
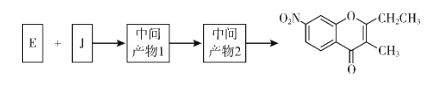
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2NH![]() =Mg2++2NH3·H2O
=Mg2++2NH3·H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:CO![]() +2CH3COOH=2CH3COO-+H2O+CO2↑
+2CH3COOH=2CH3COO-+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com