
【题目】硫脲[SC(NH2)2]别名硫代尿素,是一种白色固体,熔点182℃。硫脲可代替氰化物用于提炼金的新工艺。酸性条件下,硫脲在氧化剂(如Fe3+、H2O2、O2)存在下能溶解金,形成配离子Au[SC(NH2)2]![]() 。
。
回答下列问题:
(1)C、N、S三种元素中第一电离能最大的是___(填元素符号)。
(2)Au与Cu同族,价电子排布式为5d106s1,Au位于元素周期表的___区,Au+的价电子排布式为___。
(3)硫脲分子中碳原子的杂化方式为___,σ键和π键数目之比为___。
(4)写出硫脲在硫酸铁存在下溶解金的离子方程式___。
(5)硫脲加热到150℃时可转变成硫氰酸铵(NH4SCN),SCN-的空间构型为___形。
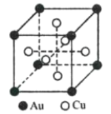
(6)一种铜金合金晶体具有面心立方最密堆积的结构,其晶胞如图所示,则该合金中Au原子与Cu原子个数之比为___。若铜和金的半径分别为apm和bpm,相对原子质量分别为MA和MB,阿伏加德罗常数的值为NA,计算晶体的密度为___g/cm3。
【答案】N ds 5d10 sp2杂化 7:1 2SC(NH2)2+Au+Fe3+=Au[SC(NH2)2]![]() +Fe2+ 直线 1:3
+Fe2+ 直线 1:3 
【解析】
氮元素的核外电子排布呈半满状态,第一电离能大于相邻元素的第一电离能;铜元素位于第四周期IB族;硫脲分子中碳原子与硫原子形成双键,碳原子与氮原子、氮原子与氢原子形成单键;硫脲与Fe3+发生氧化还原反应,生成Au[SC(NH2)2]![]() 和Fe2+;SCN-与二氧化碳互为等电子体;晶胞中Au原子位于顶点,Cu原子位于面心。
和Fe2+;SCN-与二氧化碳互为等电子体;晶胞中Au原子位于顶点,Cu原子位于面心。
(1)因氮元素核外电子排布呈半满状态,故C、N、S三种元素中第一电离能最大的是N。
(2)Au与Cu同族,位于IB族,根据价电子排布式为5d106s1,Au位于元素周期表的ds区,Au失去最外层1个电子形成Au+,Au+价电子排布式为5d10。
(3)硫脲分子[SC(NH2)2]中碳原子的价电子数为![]() ,采取sp2杂化方式;该分子中共1个碳硫双键,4个氮氢单键和2个碳氮单键,则σ键和π键数目之比为7:1。
,采取sp2杂化方式;该分子中共1个碳硫双键,4个氮氢单键和2个碳氮单键,则σ键和π键数目之比为7:1。
(4)硫脲在氧化剂(如Fe3+、H2O2、O2)存在下能溶解金,形成配离子Au[SC(NH2)2]![]() ,则脲在硫酸铁存在下溶解金的离子方程式为2SC(NH2)2+Au+Fe3+=Au[SC(NH2)2]
,则脲在硫酸铁存在下溶解金的离子方程式为2SC(NH2)2+Au+Fe3+=Au[SC(NH2)2]![]() +Fe2+。
+Fe2+。
(5) SCN-与二氧化碳互为等电子体,两者空间构型相同,均为直线形。
(6)Au原子位于晶胞顶点,原子个数为![]() ,Cu原子位于晶胞面心,原子个数为
,Cu原子位于晶胞面心,原子个数为![]() ,则Au原子与Cu原子个数之比为1:3;若铜和金的半径分别为apm和bpm,则晶胞参数为
,则Au原子与Cu原子个数之比为1:3;若铜和金的半径分别为apm和bpm,则晶胞参数为![]() pm,则晶体的密度为
pm,则晶体的密度为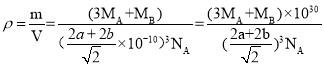 g/cm3。
g/cm3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图所示的装置,对纯碱(碳酸钠)和小苏打(碳酸氢钠)两种固体进行实验探究:
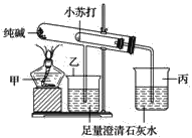
(1)写出甲、丙两种仪器的名称:______________,________________。
(2)在实验过程中,观察到丙仪器中的澄清石灰水变浑浊,请写出丙仪器中发生反应的化学方程式______________________。
(3)该实验探究利用的科学方法是__________________(填“控制变量法”、“对比观察法”或“定量分析法”),实验目的是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环中不存在碳碳单键和碳碳双键交替的结构,可以作为证据的事实是( )
①苯是无色易挥发的液体;
②苯不能使酸性高锰酸钾溶液褪色;
③![]() 和
和 是同一种物质。
是同一种物质。
A. ①②③ B. ①和② C. ①和③ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
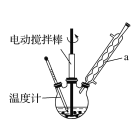
(1)装置a的名称是______________,为使反应体系受热比较均匀,可________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________________________。
(3)写出苯甲醛与银氨溶液在一定的条件下发生反应的化学方程式:________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过____________、__________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是______________(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品,实验室用硝酸氧化淀粉液水解制取草酸的装置如图所示(加热搅拌和仪器固定装置已略去)。
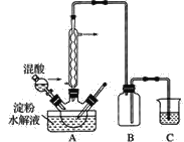
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO2与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却、抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+2HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
回答下列问题:
(1)检验淀粉是否水解完全所需用的试剂为__。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_。
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO全部吸收,原因是__(用化学方程式表示)。
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是什么?__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数如下表。则从表格中判断以下说明不正确的是( )
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________反应(填“吸热”或“放热”),且m+n________p(填“>”、“=”或“<”)。
(2)减压使容器体积增大时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率____________。
(4)若升高温度,则平衡时B、C的浓度之比将____________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com