
【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数如下表。则从表格中判断以下说明不正确的是( )
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO、少量Pb。CuO和As2O3)制取高纯锌的工艺流程如图所示。
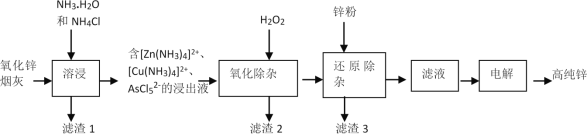
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的___性。
(2)“溶浸”时,氧化锌参与反应的相关离子方程式是____。
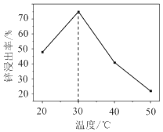
(3)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为___。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是____。
(5)“滤渣3”的主要成分为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫脲[SC(NH2)2]别名硫代尿素,是一种白色固体,熔点182℃。硫脲可代替氰化物用于提炼金的新工艺。酸性条件下,硫脲在氧化剂(如Fe3+、H2O2、O2)存在下能溶解金,形成配离子Au[SC(NH2)2]![]() 。
。
回答下列问题:
(1)C、N、S三种元素中第一电离能最大的是___(填元素符号)。
(2)Au与Cu同族,价电子排布式为5d106s1,Au位于元素周期表的___区,Au+的价电子排布式为___。
(3)硫脲分子中碳原子的杂化方式为___,σ键和π键数目之比为___。
(4)写出硫脲在硫酸铁存在下溶解金的离子方程式___。
(5)硫脲加热到150℃时可转变成硫氰酸铵(NH4SCN),SCN-的空间构型为___形。
(6)一种铜金合金晶体具有面心立方最密堆积的结构,其晶胞如图所示,则该合金中Au原子与Cu原子个数之比为___。若铜和金的半径分别为apm和bpm,相对原子质量分别为MA和MB,阿伏加德罗常数的值为NA,计算晶体的密度为___g/cm3。
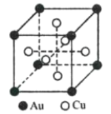
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
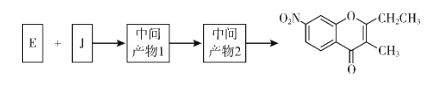
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如下:
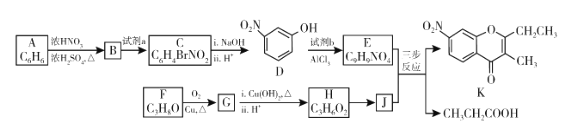
已知:
①
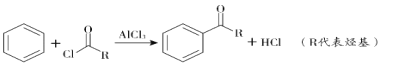
②
![]()
③
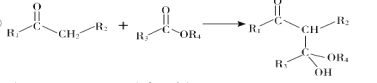
(![]() 代表烃基)
代表烃基)
(1)A的结构简式是_________;根据系统命名法,F的名称是__________。
(2)B→C所需试剂a是__________;试剂b的结构简式是_________。
(3)C与足量的![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(4)G与新制![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(5)已知:①![]() ;②J分子中有两种化学环境不同的氢以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:__________
;②J分子中有两种化学环境不同的氢以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查询资料后得到如下信息:柠檬烯(![]() )的沸点为177℃,熔点为-74.3℃,密度为0.84 g/mL,具有良好的镇咳、祛痰、抑菌作用,广泛存在于天然的植物精油中。
)的沸点为177℃,熔点为-74.3℃,密度为0.84 g/mL,具有良好的镇咳、祛痰、抑菌作用,广泛存在于天然的植物精油中。
(一)粗精油的提取。该同学利用如图所示装置(加热、夹持及冷凝管内管均省略)从植物组织中获取粗精油,实验步骤如下:
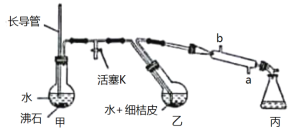
i.将几片桔子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水;
ii.打开活塞K,加热甲至K处的支管口有大量水蒸气冒出时旋紧,再打开冷凝水,水蒸气蒸馏即开始进行。可观察到在馏出液的水面上有一层很薄的油层。
(1)甲中长导管的作用是___________。蒸馏结束时,应先将_____________,再停止加热。
(2)冷凝管的内管应是_________(填“蛇”“球”或“直”)形的。若冷却水从b口进入,则对提取到精油量的影响情况是____________。
(二)柠檬烯的提取。
i.将馏出液加入到仪器A中,然后加入适量的CH2Cl2(沸点为40℃)萃取3次,最后将萃取液置于干燥的锥形瓶中,并加入适量的试剂A干燥半个小时。
ii.将干燥好的溶液加入蒸馏烧瓶中,通过一系列操作,最后烧瓶中剩下的橙黄色液体就是柠檬烯。
(3)仪器A是_________,试剂A可以是_______(写出两种)。若将一定量的橙黄色液体滴入溴的CCl4溶液中,溶液褪色,由此现象可得出的恰当结论是____________。
(4)若桔皮总质量为a g,最后得到V mL柠檬烯,实验过程中柠檬烯的总损失率为b% ,则枯皮中柠檬烯的质量分数为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用实验I验证Fe2(SO4)3与Cu的反应,观察到了异常现象,决定对其进行深入探究。
实验I:
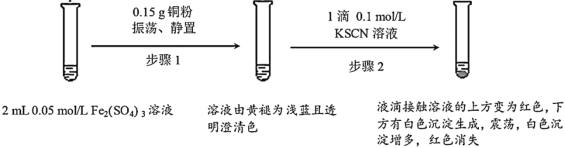
(1)Fe2(SO4)3溶液常温下呈酸性的原因是___。
(2)Fe2(SO4)3与KSCN溶液反应的离子方程式为___。
(3)实验前,小组同学预测经过步骤2后溶液不应该呈现红色,依据是__。
(4)实验小组对白色沉淀的产生进行了深入探究
查阅资料:i.CuSCN为难溶于水的白色固体。
ii.SCN-被称为拟卤素离子,性质与卤素离子相似
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能
猜测1:Cu2+与KSCN发生了氧化还原反应
猜测2:亚铁离子将其还原Cu2++Fe2+=Cu++Fe3+,Cu++SCN-=CuSCN↓
为证实猜想小组同学做了实验II和III。(FeSO4和CuSO4溶液浓度为0.1mol/L,KSCN溶液浓度为0.4mol/L)
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
II |
| 加入1mLKSCN溶液 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
| 加入1mLKSCN溶液 | 溶液变成绿色 |
①猜测1的离子方程式____;
②实验II中试管__(填字母)中的现象可以证实猜测1不成立。
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈红色 | ||
| 加入4mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈浅红色 | ||
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
(5)Fe3+的氧化性本应强于Cu2+,结合实验III中的现象解释Cu2++Fe2+=Cu++Fe3+能正向发生的原因是___。
(6)实验小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com