
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
A. 体积不变,充入氮气使压强增大 B. 体积缩小一半
C. 压强不变,充入氮气使体积增大 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组分析了用硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO等)制备铁红(Fe2O3)的流程图并进行了铁红性质实验。
(一)铁红制备的流程图
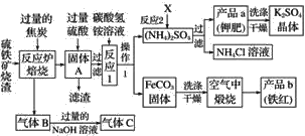
(1)写出焙烧中一氧化碳与氧化铁反应的化学方程式:______________________。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和____________(填仪器名称)。
(3)你认为对气体C最佳的处理方法是________(填选项序号)。
A.冷却后排入空气
B.燃烧后排放
C.再通入反应炉
(4)反应1的反应温度一般需控制在35 ℃以下,其目的是______________________________。
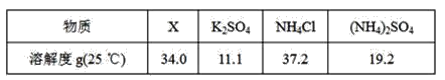
(5)反应2中相关物质的溶解度如表,你认为该反应在常温下能实现的原因是:_____。
洗涤干燥得到硫酸钾晶体时,可选用下列______(选填序号,下同)洗涤剂
A.氯化钾饱和溶液
B.水
C.硫酸钾饱和溶液
为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入________,振荡、静置,再向上层清液中滴加________,观察现象即可判断。
A.硝酸银溶液
B.过量的氯化钡溶液
C.过量的硝酸钡溶液
(二)铁红的性质实验
(1)实验装置
已知:草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
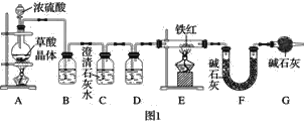
①实验前应先______________________。
②进入E中的气体是纯净、干燥的一氧化碳,则B、D中的试剂依次是______、______(填字母编号)。
A.浓硫酸
B.澄清的石灰水
C.氢氧化钠溶液
③C装置的作用是________________________________。
(2)数据分析与计算:
用SDTQ600热分析仪对氧化铁和一氧化碳进行热反应分析,获得相关数据,绘制成管内剩余固体质量与反应温度的关系如图2。

已知铁的氧化物有FeO、Fe3O、Fe2O3,在一定的条件下,都能够逐步失去其中的氧,最终被还原为铁。
①800 ℃以上时,管内固体成分的化学式为___________。
②写出管内固体质量由48 g变为46.4 g时反应的化学方程式:________________________。
(3)实验评价
请指出问题讨论中实验装置的一个明显缺陷:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C. 氢气和碘蒸气反应达平衡后加压颜色加深
D. 硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
B.Fe(OH)2与足量稀硝酸反应:Fe(OH)2+2H+=Fe2++2H2O
C.Na2S碱性溶液中通入SO2生成Na2S2O3:3SO2+S2-=2S2O![]()
D.KMnO4酸性溶液与SO2反应:2MnO![]() +5SO2+4OH-=2Mn2++5SO
+5SO2+4OH-=2Mn2++5SO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解熔融氧化铝来制取金属铝,关于该反应的下列说法不正确的是
A.属于分解反应
B.属于氧化还原反应
C.金属铝是氧化产物
D.说明氧化铝是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO、少量Pb。CuO和As2O3)制取高纯锌的工艺流程如图所示。
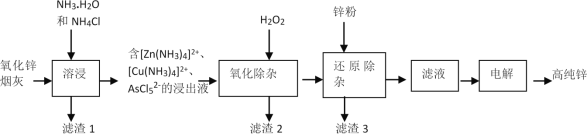
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的___性。
(2)“溶浸”时,氧化锌参与反应的相关离子方程式是____。
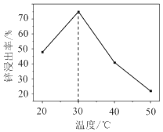
(3)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为___。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是____。
(5)“滤渣3”的主要成分为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com