
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】反应2SO2(g)+O2(g)![]() 2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
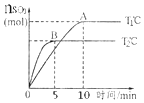
(1)反应后18O原子存在于哪些物质中___(填化学式)。
(2)上述反应的温度T1___ T2(填“>”“<”或“=”)。
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,则:
①平衡时体系内所含物质总的物质的量为___。
②平衡时SO3的浓度为___。
③下列说法不正确的是___。
A.如在该反应体系中加入适当的催化剂,可加快化学反应速率
B.其它条件相同时,该反应在T1时生成SO3的速率比T2时的小
C.该反应到达平衡时,体系内各组分的体积分数保持不变
D.若密闭容器中混合气体密度不变,则该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.5 mol钠、0.5 mol镁分别放入20 mL 1 mol·L-1的盐酸中,下列说法正确的是( )
A.钠与盐酸反应比镁剧烈B.镁与盐酸反应比钠剧烈
C.反应结束时钠、镁都有剩余D.反应结束时产生的气体一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
A.若该反应是放热反应,则a<0
B.用NO表示的平均化学反应速率v(NO)为0.16mol/(L·min)
C.达到化学平衡时,CO的转化率是80%
D.保持温度不变,若再向上述达到平衡的体系中充入2mol NO 和2mol CO,则反应重新达到平衡时c(N2)等于0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~D四组反应中,Ⅰ和Ⅱ可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | 把金属铁放入稀硫酸中 | 把金属铁放入稀硝酸中 |
B | 氯化铝溶液中加入少量的NaOH溶液 | NaOH溶液中加入少量的氯化铝溶液 |
C | 稀硫酸中加入少量的氢氧化钡溶液 | 氢氧化钡溶液中加入少量的稀硫酸 |
D | 将少量Na2CO3溶液滴入足量HCl溶液中 | 将少量HCl溶液滴入足量Na2CO3溶液中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析比较氧化铁和氧化亚铁的性质:
(1)写出下列反应的化学方程式:
①氧化铁与一氧化碳反应______________________;
②氧化铁与铝发生铝热反应____________________;
③氢气还原氧化亚铁________________________;
④氧化亚铁在高温下转化为四氧化三铁_____________________。
(2)上述各反应中氧化铁或氧化亚铁表现的氧化性或还原性:
①___________________;②____________________;
③___________________;④_____________________。
(3)从铁元素的化合价分析说明:
①氧化铁具有的性质_______________________________。
②氧化亚铁具有的性质_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用NaOH溶液滴定X(NaH2PO4或NH4Cl)的稀溶液,溶液pH与n(NaOH)/n(X)的关系如图所示,已知:pKa=-lgKa,H2PO![]() +PO
+PO![]()
![]() 2HPO
2HPO![]() 。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
。室温时下列指定溶液中微粒的物质的量浓度关系正确的是( )
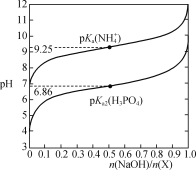
A.0.1mol·L-1NH4Cl溶液中滴加氨水至溶液呈中性:c(Cl-)=c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
B.0.1mol·L-1NaH2PO4溶液中滴加NaOH至溶液呈中性:c(Na+)>3c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
C.0.1mol·L-1NaH2PO4溶液中滴加K3PO4至溶液呈中性:c(K+)>c(Na+)
D.0.1mol·L-1NaH2PO4溶液中滴加氨水至溶液呈中性:c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )>2c(NH
)>2c(NH![]() )+2c(NH3·H2O)
)+2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,硫被称为“生命元素”,它们形成的物质种类非常丰富,在生产、生活中用途广泛。
(1)基态S原子有___种能量不同的电子,其价电子排布图为___。
(2)硫能形成S2O![]() 、SO
、SO![]() 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O![]() 的空间构型为___,SO
的空间构型为___,SO![]() 的中心原子杂化方式为___。
的中心原子杂化方式为___。
(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的___区。
②SCN-的三种元素的电负性由大到小的顺序为___(用元素符号表示)。写出与SCN-互为等电子体的分子的分子式___(任写一种)。
③Fe(SCN)3中不存在的化学键有___(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.σ键 F.π键
(4)部分卤化铁的熔点如下表所示:
卤化铁 | FeF3 | FeCl3 |
熔点/℃ | 1100 | 306 |
解释表中物质之间熔点差异的原因___。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。
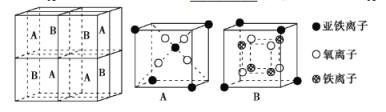
①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为___。
②己知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为___ nm(用含d和NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com