
【题目】下列A~D四组反应中,Ⅰ和Ⅱ可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | 把金属铁放入稀硫酸中 | 把金属铁放入稀硝酸中 |
B | 氯化铝溶液中加入少量的NaOH溶液 | NaOH溶液中加入少量的氯化铝溶液 |
C | 稀硫酸中加入少量的氢氧化钡溶液 | 氢氧化钡溶液中加入少量的稀硫酸 |
D | 将少量Na2CO3溶液滴入足量HCl溶液中 | 将少量HCl溶液滴入足量Na2CO3溶液中 |
A.AB.BC.CD.D
【答案】C
【解析】
A.铁和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑,铁和足量稀硝酸反应生成硝酸铁、一氧化氮、水,离子方程式为Fe+![]() +4H+=Fe3++NO↑+2H2O,不能用同一个离子方程式表示,故不选A;
+4H+=Fe3++NO↑+2H2O,不能用同一个离子方程式表示,故不选A;
B.氯化铝溶液中加入少量的NaOH溶液生成氢氧化铝沉淀和氯化钠,离子方程式为Al3++3OH-=Al(OH)3↓,NaOH溶液中加入少量的氯化铝溶液生成偏铝酸钠和氯化钠,离子方程式为Al3++4OH-=![]() +2H2O,不能用同一个离子方程式表示,故不选B;
+2H2O,不能用同一个离子方程式表示,故不选B;
C.稀硫酸中加入少量的氢氧化钡溶液、氢氧化钡溶液中加入少量的稀硫酸,都可用离子方程式Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O表示,故选C;
+2H+=BaSO4↓+2H2O表示,故选C;
D.将少量Na2CO3溶液滴入足量HCl溶液中生成氯化钠、二氧化碳、水,离子方程式为2H++![]() =CO2↑+H2O,将少量HCl溶液滴入足量Na2CO3溶液中生成碳酸氢钠、氯化钠,离子方程式为H++
=CO2↑+H2O,将少量HCl溶液滴入足量Na2CO3溶液中生成碳酸氢钠、氯化钠,离子方程式为H++![]() =
=![]() ,不能用同一个离子方程式表示,故不选D;
,不能用同一个离子方程式表示,故不选D;
选C。


科目:高中化学 来源: 题型:
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
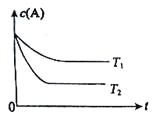
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组分析了用硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO等)制备铁红(Fe2O3)的流程图并进行了铁红性质实验。
(一)铁红制备的流程图
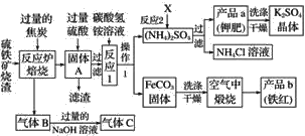
(1)写出焙烧中一氧化碳与氧化铁反应的化学方程式:______________________。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和____________(填仪器名称)。
(3)你认为对气体C最佳的处理方法是________(填选项序号)。
A.冷却后排入空气
B.燃烧后排放
C.再通入反应炉
(4)反应1的反应温度一般需控制在35 ℃以下,其目的是______________________________。
(5)反应2中相关物质的溶解度如表,你认为该反应在常温下能实现的原因是:_____。
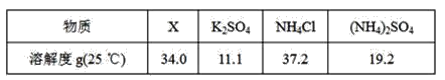
洗涤干燥得到硫酸钾晶体时,可选用下列______(选填序号,下同)洗涤剂
A.氯化钾饱和溶液
B.水
C.硫酸钾饱和溶液
为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入________,振荡、静置,再向上层清液中滴加________,观察现象即可判断。
A.硝酸银溶液
B.过量的氯化钡溶液
C.过量的硝酸钡溶液
(二)铁红的性质实验
(1)实验装置
已知:草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
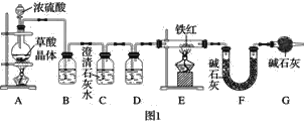
①实验前应先______________________。
②进入E中的气体是纯净、干燥的一氧化碳,则B、D中的试剂依次是______、______(填字母编号)。
A.浓硫酸
B.澄清的石灰水
C.氢氧化钠溶液
③C装置的作用是________________________________。
(2)数据分析与计算:
用SDTQ600热分析仪对氧化铁和一氧化碳进行热反应分析,获得相关数据,绘制成管内剩余固体质量与反应温度的关系如图2。

已知铁的氧化物有FeO、Fe3O、Fe2O3,在一定的条件下,都能够逐步失去其中的氧,最终被还原为铁。
①800 ℃以上时,管内固体成分的化学式为___________。
②写出管内固体质量由48 g变为46.4 g时反应的化学方程式:________________________。
(3)实验评价
请指出问题讨论中实验装置的一个明显缺陷:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸(0.1000mol/L)来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________直到加入最后一滴盐酸后,溶液由黄色变为_________色,并_________________________为止。
(2)滴定开始和结束时滴定管的液面如图所示,则终点读数为_____mL;所用盐酸体积为_____mL。
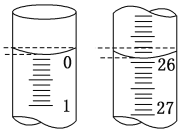
(3)对下列几种假设情况进行讨论:(填“偏高”、“偏低”或“无影响”)
①若滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,则可能使所测NaOH溶液的浓度数值_________;
②若酸式滴定管在滴定前有气泡,滴定后气泡消失,则可能使所测NaOH溶液的浓度数值_______。
(4)有关数据记录如下:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.40 |
第二次 | 20.00 | 0.00 | 25.10 |
根据所给数据,计算出待测NaOH溶液的浓度为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C. 氢气和碘蒸气反应达平衡后加压颜色加深
D. 硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解熔融氧化铝来制取金属铝,关于该反应的下列说法不正确的是
A.属于分解反应
B.属于氧化还原反应
C.金属铝是氧化产物
D.说明氧化铝是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验中取![]() 的NaOH溶液50mL与
的NaOH溶液50mL与![]() 的硫酸50mL置于下图所示的装置中,进行中和热的测定实验,回答下列问题:
的硫酸50mL置于下图所示的装置中,进行中和热的测定实验,回答下列问题:
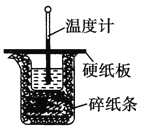
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 ______ ;
(2)大烧杯上如不盖硬纸板,求得的中和热数值____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() ;
;
(3)若![]() 溶液和
溶液和![]() 硫酸溶液的密度都是
硫酸溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,通过以下数据计算中和热
,通过以下数据计算中和热![]() _______
_______![]() 结果保留小数点后一位
结果保留小数点后一位![]() 。
。
温度实验次数 | 起始温度 | 终止温度 | ||
| NaOH | 平均值 | ||
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
(4)如果用![]() 盐酸与
盐酸与![]() 溶液进行反应,与上述实验相比,所放出的热量____
溶液进行反应,与上述实验相比,所放出的热量____![]() 填“相等、不相等”
填“相等、不相等”![]() ,所求中和热____
,所求中和热____![]() 填“相等、不相等”
填“相等、不相等”![]() 。
。
(5)用相同浓度和体积的氨水![]() 代替NaOH溶液进行上述实验,测得的中和热的数值会____。
代替NaOH溶液进行上述实验,测得的中和热的数值会____。![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com