
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室可以用排饱和食盐水的方法收集氯气
B. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C. 高压有利于工业上合成氨
D. 打开汽水瓶时,瓶中立即泛起大量泡沫
【答案】B
【解析】
A、氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应:Cl2+H2O![]() HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可用勒夏特列原理解释,故A不选;
HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可用勒夏特列原理解释,故A不选;
B、将铜粉和锌粉混合后放入稀硫酸中,构成原电池,加快反应速率,不能用勒夏特列原理解释,故B选;
C、合成氨的正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,为提高NH3的产率,理论上应采取高压措施,所以能用勒夏特列原理解释,故C不选;
D、汽水瓶中存在平衡H2CO3![]() H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故D不选;
H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故D不选;
答案选B。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】请用你所学的化学知识回答下列问题:
(1)Na、Mg、Al中第一电离能最大的是___(填元素符号),Fe原子基态电子排布式为___。
(2)下列反应可用于检测司机是否酒后驾驶:2Cr2O![]() +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___(填元素符号)。
②1molCH3COOH分子含有σ键的数目为___NA。
③H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为___。
(3)S元素的最高价氧化物在气态时以单分子形式存在,中心原子的杂化方式为___杂化,其分子的立体构型为___。H2O、H2S、H2Se沸点由低到高的顺序___。
(4)将Cu的粉末加入浓氨水中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是___。
(5)金属元素X和非金属元素Y生成某化合物的晶胞如图(X用白球表示,Y用黑球表示),则该化合物的化学式为___。
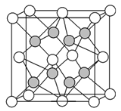
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。298K时,
。298K时,![]() ,
,![]() ,
,![]() 。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
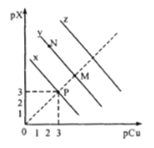
A.298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x代表CuI曲线,且P点c(Cu+)=c(Cl-)
C.298K时增大M点的阴离子浓度,则y上的点向N点移动
D.298K时![]() 的平衡常数K的数量级为103或102
的平衡常数K的数量级为103或102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国工程院院士、国家卫健委高级别专家组成员李兰娟团队,于2月4日公布阿比朵尔、达芦那韦可抑制新型病毒。如图所示有机物是合成阿比朵尔的原料,关于该有机物下列说法正确的是
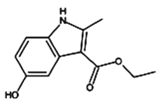
A.分子式为C12H14NO3
B.易溶于水和有机溶剂
C.分子结构中含有三种含氧官能团
D.可以发生加成反应、取代反应、水解反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃时,将4molSO2与2molO2放入4L的密闭容器中,5分钟后反应达到平衡:2SO2+O2![]() 2SO3,测得平衡时SO3的浓度为0.5mol·L-1。
2SO3,测得平衡时SO3的浓度为0.5mol·L-1。
(1)在500℃时,该反应平衡常数K=_____
(2)反应达到平衡时,SO2的转化率为______
(3)从开始反应至达到平衡状态 反应速率v(O2)=_____
(4)该反应在低温时能自发进行,则该反应的正反应是_____(填“放热”或“吸热”)反应
(5)在500℃时,在2L的密闭容器中,发生上述反应,某一时刻测得容器内SO2、O2、SO3的物质的量分别为1mol、2mol、2mol则此时正逆反应速率大小为v(正)____v(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,气态分子断开1mol化学键所需的能量称为键能。已知H-H,H-O,和O=O键的键能分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(g)△H=-485kJ/mol
O2(g)△H=-485kJ/mol
B.H2O(g)=H2(g)+![]() O2(g)△H=+485kJ/mol
O2(g)△H=+485kJ/mol
C.2H2(g)+O2(g)=2H2O(g)△H=+485kJ/mol
D.2H2(g)+O2(g)=2H2O(g)△H=-485kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;
Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=____________________(用含有ΔH1、ΔH2和ΔH3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
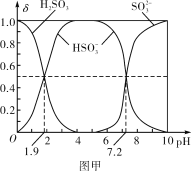
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因_____________________________________________________。
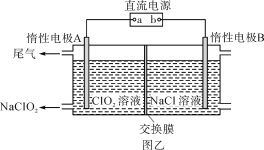
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)![]() S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
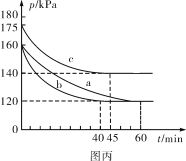
(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为__________(填字母序号)。
②与实验a相比,c组改变的实验条件可能是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入等物质的量A、B,发生如下反应:2A(g)+2B(g)![]() 3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
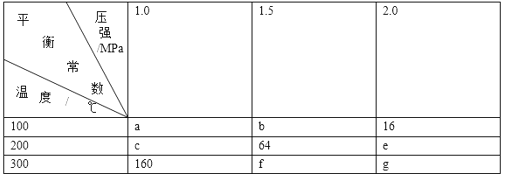
下列判断正确的是( )
A.g>f
B.△H<0
C.2.0MPa、300℃时,A的平衡转化率最小
D.1.5MPa、100℃时,B的平衡转化率为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com