
°ĺŐ‚ńŅ°Ņľł÷÷∂Ő÷‹∆ŕ‘™ňōĶń‘≠◊”įŽĺ∂ľį÷ų“™ĽĮļŌľŘ»ÁŌ¬ĪŪ:Ō¬Ń––ū Ų’ż»∑Ķń «( )
‘™ňōīķļŇ | X | Y | Z | W |
‘≠◊”įŽĺ∂/pm | 160 | 143 | 70 | 66 |
÷ų“™ĽĮļŌľŘ | +2 | +3 | +5°Ę+3°Ę-3 | -2 |
A.X°ĘW‘™ňōĶńņŽ◊”įŽĺ∂ W<X
B.“Ľ∂®ŐűľĢŌ¬,WĶ•÷ Ņ…“‘”ŽZ‘™ňōĶń«‚ĽĮőÔ∑Ę…ķĽĮ—ß∑ī”¶
C.YĶń◊ÓłŖľŘ—űĽĮőÔ∂‘”¶ĶńňģĽĮőÔń‹»‹”ŕŌ°įĪňģ
D.“Ľ∂®ŐűľĢŌ¬,ZĶ•÷ ”ŽWĶń≥£ľŻĶ•÷ ÷ĪĹ”…ķ≥…ZW2
°ĺīūįł°ŅB
°ĺĹ‚őŲ°Ņ
X°ĘY°ĘZ°ĘW∂ľ «∂Ő÷‹∆ŕ‘™ňō£¨W”–-2ľŘī¶”ŕVIA◊Ś‘ÚWő™O‘™ňō£ĽZ”–+5°Ę-3ľŘ£¨ī¶”ŕVA◊Ś£¨ZĶńįŽĺ∂Ī»OĶń…‘īů£¨‘ÚZő™N‘™ňō£ĽX°ĘYĶń‘≠◊”įŽĺ∂Ī»N°ĘOĶńįŽĺ∂īůļ‹∂ŗ£¨‘ÚX°ĘY‘ŕĶ໿÷‹∆ŕ£¨X”–+2ľŘ£¨‘ÚXő™Mg£¨Y”–+3ľŘ£¨‘ÚYő™Al°£
A£ģļňÕ‚ĶÁ◊”ŇŇ≤ľŌŗÕ¨Ķń«ťŅŲŌ¬£¨‘≠◊”–Ú ż‘Ĺīů£¨įŽĺ∂‘Ĺ–°£¨“ÚīňO2-£ĺMg2+£¨AīŪőů£Ľ
B£ģO2ļÕNH3‘ŕīŖĽĮľŃĶńŐűľĢŌ¬Ņ…“‘∑Ę…ķīŖĽĮ—űĽĮ£ļ![]() £¨B’ż»∑£Ľ
£¨B’ż»∑£Ľ
C£ģAl(OH)3ń‹”Ž«ŅľÓ∑ī”¶£¨≤Ľń‹łķ»űľÓįĪňģ∑ī”¶£¨CīŪőů£Ľ
D£ģN2”ŽO2‘ŕ∑ŇĶÁĶńŐűľĢŌ¬ń‹…ķ≥…NO£¨≤Ľń‹÷ĪĹ”…ķ≥…NO2£¨DīŪőů£Ľ
Ļ —°B°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ‘ŕ300 mLĶń√‹Ī’»›∆ų÷–£¨∑Ň»ŽńÝ∑Ř≤Ę≥š»Ž“Ľ∂®ŃŅĶńCO∆ÝŐŚ£¨“Ľ∂®ŐűľĢŌ¬∑Ę…ķ∑ī”¶£ļNi(s)£ę4CO(g)Ni(CO)4(g)£¨“—÷™ł√∑ī”¶∆Ĺļ‚≥£ ż”Žő¬∂»ĶńĻōŌĶ»ÁĪŪ£ļ
ő¬∂»/°ś | 25 | 80 | 230 |
∆Ĺļ‚≥£ ż | 5°Ń104 | 2 | 1.9°Ń10£≠5 |
Ō¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «£® £©
A.…żő¬≤ĽņŻ”ŕ’ż∑ī”¶…ķ≥…Ni(CO)4(g)
B.‘ŕ25 °ś Ī£¨∑ī”¶Ni(CO)4(g)Ni(s)£ę4CO(g)Ķń∆Ĺļ‚≥£ żő™2°Ń10£≠5
C.‘ŕ80 °ś Ī,≤‚Ķ√ń≥ ĪŅŐ£¨Ni(CO)4°ĘCOŇ®∂»ĺýő™0.5 mol°§L£≠1£¨‘Úīň Īv’ż>vńś
D.‘ŕ80 °śīÔĶĹ∆Ĺļ‚ Ī£¨≤‚Ķ√n(CO)£Ĺ0.3 mol£¨‘ÚNi(CO)4Ķń∆Ĺļ‚Ň®∂»ő™2 mol°§L£≠1
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ»ż “ ĹĶÁ…ÝőŲ∑®ī¶ņŪļ¨Na2SO4∑ŌňģĶń‘≠ņŪ»ÁÕľňý ĺ£¨≤…”√∂Ť–‘ĶÁľę£¨ab°Ęcdĺýő™ņŽ◊”ĹĽĽĽń§£¨‘ŕ÷ĪŃųĶÁ≥°Ķń◊ų”√Ō¬£¨ŃĹń§÷–ľšĶńNa+ļÕSO42-Ņ…Õ®ĻżņŽ◊”ĹĽĽĽń§£¨∂ÝŃĹ∂ňłŰ “÷–ņŽ◊”ĪĽ◊ŤĶ≤≤Ľń‹ĹÝ»Ž÷–ľšłŰ “°£Ō¬Ń––ū Ų’ż»∑Ķń «

A. Õ®ĶÁļů÷–ľšłŰ “ĶńSO42-ņŽ◊”ŌÚ’żľę«®“∆£¨’żľę«Ý»‹“ļpH‘Ųīů
B. ł√∑®‘ŕī¶ņŪļ¨Na2SO4∑Ōňģ ĪŅ…“‘Ķ√ĶĹNaOHļÕH2SO4≤ķ∆∑
C. łļľę∑ī”¶ő™2H2O®C4e®C=O2+4H+£¨łļľę«Ý»‹“ļpHĹĶĶÕ
D. ĶĪĶÁ¬∑÷–Õ®Ļż1molĶÁ◊”ĶńĶÁŃŅ Ī£¨ĽŠ”–0.5molĶńO2…ķ≥…
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ—űļÕŃÚĶńĽĮļŌőÔ‘ŕĽĮĻ§…ķ≤ķ…Ō”¶”√∑«≥£Ļ„∑ļ. ‘ĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©≥Ű—űľłļűŅ…”Ž≥ż≤¨°ĘĹū°Ę“Ņ°Ę∑ķ“‘Õ‚Ķńňý”–Ķ•÷ ∑ī”¶°£
ľļ÷™£ļ6Ag£®s£©+O3£®g£©®T3Ag2O£®s£©£Ľ°ųH=©Ā235kJ/mol£Ľ
2Ag2O£®s£©®T4Ag£®s£©+O2£®g£©£Ľ°ųH=+60kJ/mol£Ľ
‘Ú∑ī”¶2O3£®g£©=3O2£®g£©Ķń°ųH=___°£
£®2£©SO2Cl2≥£”√”ŕ÷∆‘ž“Ĺ“©∆∑°Ę»ĺŃŌ°ĘĪŪ√śĽÓ–‘ľŃĶ».“—÷™£ļSO2Cl2£®g£©![]() SO2£®g£©+Cl2£®g£©°ųH=akJmol©Ā1°£300°ś ĪŌÚŐŚĽżő™2LĶńļ„»›√‹Ī’»›∆ų÷–≥š»Ž0.20molSO2Cl2£¨īÔĶĹ∆Ĺļ‚ Ī£¨»›∆ų÷–ļ¨0.1molSO2£¨ł√ő¬∂» Ī∑ī”¶Ķń∆Ĺļ‚≥£ żő™___°£Ĺę…Ō ŲňýĶ√ĽžļŌ∆ÝŐŚ»‹”ŕ◊„ŃŅBaCl2»‹“ļ÷–£¨◊Ó÷’…ķ≥…≥ŃĶŪĶń÷ ŃŅő™___°£
SO2£®g£©+Cl2£®g£©°ųH=akJmol©Ā1°£300°ś ĪŌÚŐŚĽżő™2LĶńļ„»›√‹Ī’»›∆ų÷–≥š»Ž0.20molSO2Cl2£¨īÔĶĹ∆Ĺļ‚ Ī£¨»›∆ų÷–ļ¨0.1molSO2£¨ł√ő¬∂» Ī∑ī”¶Ķń∆Ĺļ‚≥£ żő™___°£Ĺę…Ō ŲňýĶ√ĽžļŌ∆ÝŐŚ»‹”ŕ◊„ŃŅBaCl2»‹“ļ÷–£¨◊Ó÷’…ķ≥…≥ŃĶŪĶń÷ ŃŅő™___°£
£®3£©∂‘£®2£©÷–Ķń∑ī”¶£¨‘ŕ400°ś£¨1.01°Ń105PaŐűľĢŌ¬£¨ŌÚ»›Ľżő™2LĶńļ„»›√‹Ī’»›∆ų÷–≥š»Ž“Ľ∂®ŃŅĶńSO2Cl2£¨n£®SO2£©ļÕn£®SO2Cl2£©ňś ĪľšĶńĪšĽĮ«ķŌŖ»ÁÕľňý ĺ°£
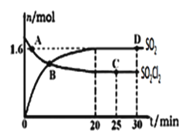
ĘŔ0°ę20min∑ī”¶Ķń∆ĹĺýňŔ¬ v£®SO2Cl2£©=___°£°ųH___0(ŐÓ°į<°Ī°į>°ĪĽÚ°į£Ĺ°Ī)∆š‘≠“Ú «£ļ___°£
ĘŕŌ¬Ń––ū Ų’ż»∑Ķń «___°£
A.AĶ„v’ż£®SO2Cl2£©£ĺvńś£®SO2Cl2£©
B.√‹∂»ļÕ∆Ĺĺýń¶∂Ż÷ ŃŅ≤ĽĪšĺýňĶ√ųī¶”ŕ∆Ĺļ‚◊īŐ¨
C.∆šňŁŐűľĢ≤ĽĪš£¨»Ű‘Ųīů—Ļ«Ņ£¨n£®SO2£©Ī»Õľ÷–DĶ„Ķń÷Ķīů
D.∆šňŁŐűľĢ≤ĽĪš£¨500°ś Ī∑ī”¶īÔ∆Ĺļ‚£¨n£®SO2£©Ī»Õľ÷–DĶ„Ķń÷Ķīů
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ»ÁÕľ «NaClĺßŐŚĶń“ĽłŲĺßįŻĶńĹŠĻĻń£–Õ(ļŕ«Úő™Cl-°Ęį◊«Úő™Na+)°£KO2ĶńĺßŐŚĹŠĻĻ”ŽNaClŌŗň∆£¨KO2Ņ…“‘Ņī◊ų «Na£ęĶńőĽ÷√”√K£ęīķŐś£¨Cl£≠ĶńőĽ÷√”√O2-īķŐś£¨‘ÚŌ¬Ń–∂‘”ŕKO2ĺßŐŚĹŠĻĻĶń√Ť Ų≤Ľ’ż»∑Ķń «(°°°°)
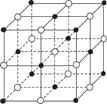
A.”ŽK£ęĺŗņŽŌŗĶ»«“◊ÓĹŁĶńK£ę”–8łŲ
B.”ŽK£ęĺŗņŽŌŗĶ»«“◊ÓĹŁĶńO2-ĻĻ≥…Ķń∂ŗ√śŐŚ «’żįň√śŐŚ
C.“ĽłŲKO2ĺßįŻ÷–ĶńK£ęļÕO2-Ń£◊” żĺýő™4łŲ
D.”ŽK£ęĺŗņŽŌŗĶ»«“◊ÓĹŁĶńO2-Ļ≤”–6łŲ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ≥£ő¬Ō¬£¨”√![]() »‹“ļ£¨∑÷ĪūĶő∂®
»‹“ļ£¨∑÷ĪūĶő∂®![]() Ň®∂»ĺýő™
Ň®∂»ĺýő™![]() »‹“ļļÕHCN»‹“ļ£¨ňýĶ√Ķő∂®«ķŌŖ»ÁÕľ°£Ō¬Ń–ňĶ∑®’ż»∑Ķń «
»‹“ļļÕHCN»‹“ļ£¨ňýĶ√Ķő∂®«ķŌŖ»ÁÕľ°£Ō¬Ń–ňĶ∑®’ż»∑Ķń «![]()

A.Ķ„![]() ļÕĶ„
ļÕĶ„![]() ňý 廋“ļ÷–£ļ
ňý 廋“ļ÷–£ļ![]()
B.ī◊ňŠĶńĶő∂®÷’Ķ„ «![]()
C.Ķő∂®![]() Ļż≥Ő÷–≤ĽŅ…ń‹≥ŲŌ÷£ļ
Ļż≥Ő÷–≤ĽŅ…ń‹≥ŲŌ÷£ļ![]()
D.Ķő∂®HCNĻż≥Ő÷–Ņ…“‘”√∑”Ő™ ‘“ļ÷ł ĺ÷’Ķ„
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥√‹Ī’»›∆ų÷–∑Ę…ķ»ÁŌ¬∑ī”¶£ļX(g)£ę3Y(g) ![]() 2Z(g)£Ľ¶§H£ľ0Ō¬ÕľĪŪ ĺł√∑ī”¶ĶńňŔ¬ £®v£©ňś Īľš£®t£©ĪšĽĮĶńĻōŌĶ£¨t2£¨t3£¨t5 ĪŅŐÕ‚ĹÁŐűľĢ”–ňýłńĪš£¨Ķę∂ľ√Ľ”–łńĪšłųőÔ÷ Ķń≥ű ľľ”»ŽŃŅ°£Ō¬Ń–ňĶ∑®÷–’ż»∑Ķń «£® £©
2Z(g)£Ľ¶§H£ľ0Ō¬ÕľĪŪ ĺł√∑ī”¶ĶńňŔ¬ £®v£©ňś Īľš£®t£©ĪšĽĮĶńĻōŌĶ£¨t2£¨t3£¨t5 ĪŅŐÕ‚ĹÁŐűľĢ”–ňýłńĪš£¨Ķę∂ľ√Ľ”–łńĪšłųőÔ÷ Ķń≥ű ľľ”»ŽŃŅ°£Ō¬Ń–ňĶ∑®÷–’ż»∑Ķń «£® £©
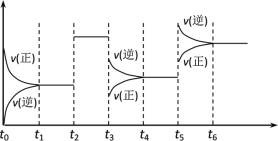
A.t2…żłŖő¬∂»B.t3 ĪĹĶĶÕŃňő¬∂»
C.t5 Ī‘ŲīůŃň—Ļ«ŅD.t5°ęt6 Īľšńŕ◊™ĽĮ¬ ◊ÓĶÕ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŃÚīķŃÚňŠń∆(Na2S2O3) «÷ō“™ĶńĽĮĻ§‘≠ŃŌ£¨Ņ…”√◊ų∑÷őŲ ‘ľŃľįų∑łÔĶńĽĻ‘≠ľŃ£¨“◊»‹”ŕňģ£¨ ‹»»°Ę”ŲňŠ“◊∑÷Ĺ‚°£Na2S2O3°§5H2O «őř…ęÕł√ųĺßŐŚ£¨“◊»‹”ŕňģ£¨∆šŌ°»‹“ļ”ŽBaCl2»‹“ļĽžļŌőř≥ŃĶŪ…ķ≥…°£Ļ§“Ķ…Ō≥£ņŻ”√ļ¨ŃÚ∑Ōňģ…ķ≤ķNa2S2O3°§5H2O£¨ń≥ĽĮ—ß–ň»§–°◊ť‘ŕ Ķ—ť “÷–”√»ÁÕľňý ĺ◊į÷√(ľ”»»◊į÷√ľį≤Ņ∑÷ľ–≥÷◊į÷√“—¬‘»•)ń£ń‚∆š…ķ≤ķĻż≥Ő≤ĘŐĹĺŅ∆šĽĮ—ß–‘÷ °£
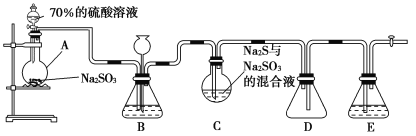
…’∆ŅC÷–∑Ę…ķ»ÁŌ¬∑ī”¶£ļ
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ĘŔ
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) Ęŕ
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) ĘŘ
Na2S2O3(aq) ĘŘ
ĘŮ.÷∆ĪłNa2S2O3°§5H2O
(1)ľ”»Ž“©∆∑÷ģ«į–ŽĹÝ––Ķń≤Ŕ◊ų «_________£Ľ◊į÷√DĶń◊ų”√ «______________£Ľ◊į÷√BĶń◊ų”√÷ģ“Ľ «ĻŘ≤žSO2Ķń…ķ≥…ňŔ¬ £¨∆š÷–Ķń ‘ľŃ◊Óļ√—°”√________(ŐÓ◊÷ńł)°£
A.’ŰŃůňģ°°°°°°°°°°°°°° B.Ī•ļÕNa2SO3»‹“ļ
C.Ī•ļÕNaHSO3»‹“ļ D.Ī•ļÕNaHCO3»‹“ļ
(2)ő™Ī£÷§ŃÚīķŃÚňŠń∆Ķń≤ķŃŅ£¨ Ķ—ť÷–≤ķ…ķĶńSO2≤Ľń‹ĻżŃŅ£¨‘≠“Ú «_________£Ľňý÷∆Ķ√Ķńī÷≤ķ∆∑Ņ…“‘Õ®Ļż________∑Ĺ∑®ĹÝ“Ľ≤ĹŐŠīŅĶ√ĶĹīŅNa2S2O3°§5H2O°£
ĘÚ.≤‚∂®≤ķ∆∑īŅ∂»
◊ľ»∑≥∆»°w g≤ķ∆∑£¨”√ ŃŅ’ŰŃůňģ»‹Ĺ‚£¨“‘ĶŪ∑Ř◊ų÷ł ĺľŃ£¨”√0.10 mol°§L£≠1I2ĶńĪÍ◊ľ»‹“ļĶő∂®°£∑ī”¶‘≠ņŪő™2S2O32-+I2=S4O62-+2I-°£
(3)Ķő∂®÷Ń÷’Ķ„ ĪĶńŌ÷Ōů£ļ______________°£Ķő∂®∆ū ľļÕ÷’Ķ„ ĪI2ĶńĪÍ◊ľ»‹“ļ“ļ√śőĽ÷√»ÁÕľňý ĺ£¨‘ÚŌŻļńI2ĶńĪÍ◊ľ»‹“ļĶńŐŚĽżő™________mL°£≤ķ∆∑ĶńīŅ∂»ő™________(…ŤNa2S2O3°§5H2OĶńŌŗ∂‘∑÷◊”÷ ŃŅő™M£¨Ń–≥Ų”√M°ĘwĪŪ ĺĶńĪŪīÔ Ĺ)°£
Ęů.ŐĹĺŅNa2S2O3Ķń≤Ņ∑÷ĽĮ—ß–‘÷
(4)£®ŐŠ≥ŲľŔ…Ť£©°°
ľŔ…Ť“Ľ£ļNa2S2O3”ŽNa2SO4ĶńĹŠĻĻŌŗň∆£¨ĽĮ—ß–‘÷ “≤”¶ł√Ōŗň∆£¨“Úīň£¨ “ő¬ ĪNa2S2O3»‹“ļĶńpH=7°£
ľŔ…Ť∂Ģ£ļī”SĶńĽĮļŌľŘÕ∆≤‚Na2S2O3ĺŖ”–ĹŌ«ŅĶńĽĻ‘≠–‘°£
£®—ť÷§ľŔ…Ť£©°°Ňš÷∆ ŃŅNa2S2O3»‹“ļ£¨ĹÝ––»ÁŌ¬ Ķ—ť£¨«ŽĹę Ķ—ť≤Ļ≥šÕÍ’Ż°£
Ķ—ť≤Ŕ◊ų | Ķ—ťĹŠ¬Ř ĽÚŌ÷Ōů | Ō÷ŌůĹ‚ Õ(”√ņŽ◊” ∑Ĺ≥Ő ĹĪŪ ĺ) | |
ľŔ…Ť“Ľ | ________ | »‹“ļpH=8 | ________ |
ľŔ…Ť∂Ģ | ŌÚšŚňģ÷– Ķő»Ž ŃŅ Na2S2O3 »‹“ļ | šŚňģÕ …ę | ________ |
Ķ—ťĹŠ¬Ř£ļ________________________________________°£
ĘŰ.Na2S2O3Ķń”¶”√
(5)Na2S2O3Ķń…Ő∆∑√Żő™°įļ£≤®°Ī£¨ň◊≥∆°įīůň’īÚ°Ī£¨ĽĮ—ß…Ō≥£”√”ŕĶő∂® Ķ—ť°£ő™≤‚∂®ń≥K2Cr2O7»‹“ļĶńŇ®∂»£¨—–ĺŅ–°◊ťĶńÕ¨—ß◊ľ»∑ŃŅ»°10.00 mL K2Cr2O7»‹“ļ”ŕ◊∂–ő∆Ņ÷–£¨ľ”»ŽĻżŃŅKIĻŐŐŚļÕ ŃŅŌ°H2SO4£¨Ķőľ”ľłĶő÷ł ĺľŃ£¨”√0.10 mol°§L£≠1 Na2S2O3ĪÍ◊ľ»‹“ļĶő∂®÷Ń÷’Ķ„£¨ĹÝ––3īő∆Ĺ–– Ķ—ťļů£¨≤‚Ķ√∆ĹĺýŌŻļńNa2S2O3»‹“ļĶńŐŚĽżő™30.00 mL£¨‘Úc(K2Cr2O7)=________mol°§L£≠1°£(“—÷™£ļCr2O72-+6I-+14H£ę=2Cr3++3I2+7H2O£¨2S2O32-+I2=S4O62-+2I-)
Ęű.ŐĹĺŅ”Ž∑īňľ
(6)ő™—ť÷§≤ķ∆∑÷–ļ¨”–Na2SO3ļÕNa2SO4£¨ł√–°◊ť…Ťľ∆Ńň“‘Ō¬ Ķ—ť∑Ĺįł£¨«ŽĹę Ķ—ť∑Ĺįł≤Ļ≥šÕÍ’Ż°£
»° ŃŅ≤ķ∆∑Ňš≥…Ō°»‹“ļ£¨___________________(ňý–Ť ‘ľŃī”BaCl2»‹“ļ°ĘŌ°HNO3°ĘŌ°H2SO4°ĘŌ°—őňŠ°Ę’ŰŃůňģ÷–—°‘Ů)°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ»ÁÕľ£¨ŃĹŌŗŃŕ‘≤»¶ńŕőÔ÷ ľšļ¨”–ŌŗÕ¨Ķńń≥“Ľ‘≠◊”£¨«“ł√‘≠◊”ĶńőÔ÷ ĶńŃŅŌŗÕ¨(…ŤNAő™įĘ∑Łľ”Ķ¬¬ř≥£ żĶń÷Ķ)°£
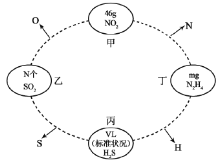
ĽōīūŌ¬Ń–ő Ő‚£ļ
(1)““÷–ĶńNő™___________£¨ĪŻ÷–ĶńVő™___________°£
(2)ľ◊÷–NO2ļÕ∂°÷–N2H4ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™___________°£
(3)““÷–SO2ļÕ∂°÷–N2H4Ķń÷ ŃŅ÷ģĪ»ő™___________°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com