
【题目】某密闭容器中发生如下反应:X(g)+3Y(g) ![]() 2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2,t3,t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2,t3,t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
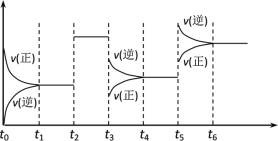
A.t2升高温度B.t3时降低了温度
C.t5时增大了压强D.t5~t6时间内转化率最低
【答案】D
【解析】
由图可知,t2时正逆反应速率同等程度增大;t3时正逆反应速率均减小,但逆反应速率大,平衡逆向移动;t5时正逆反应速率均增大,且平衡逆向移动,结合可逆反应的特点及平衡移动来解答。
A. 该反应为正反应放热的反应,t2若为升高温度,则平衡逆向移动,图像中t2时正逆反应速率同等程度增大,应为使用催化剂,故A错误;
B. 该反应为放热反应,且气体体积减小的反应,t3时正逆反应速率均减小,但逆反应速率大,平衡逆向移动,则应为减小压强,故B错误;
C. 该反应为放热反应,且气体体积减小的反应,t5时正逆反应速率均增大,且平衡逆向移动,则应为升高温度,故C错误;
D. 由图可知,t5~t6段,t5时平衡逆向移动,则t6时反应物的转化率比前面所有时刻都低,故D正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )

A. C、D、E的氢化物的稳定性:C>D>E
B. 元素A的原子最外层轨道中无自旋状态相同的电子
C. 元素B、C之间不可能形成化合物
D. 与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
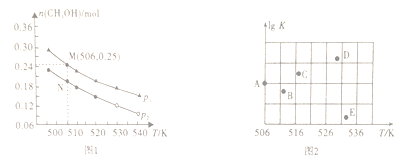
①该反应的△H_____0(填“>”、“<”或“=”),判断理由是_______________。
②M点时,CO的转化率为________。506K时该反应的平衡常数K=________(保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________。
④下列叙述能说明反应CO(g)+2H2(g) ![]() CH3OH(g)达到平衡状态的是________(填序号)。
CH3OH(g)达到平衡状态的是________(填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
A.X、W元素的离子半径 W<X
B.一定条件下,W单质可以与Z元素的氢化物发生化学反应
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
D.有机物![]() 分子中所有碳原子不可能在同一个平面上
分子中所有碳原子不可能在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和![]() 在一定条件下制备
在一定条件下制备![]() 的反应为:
的反应为:![]() ,在体积为1L的恒容密闭容器中,充人
,在体积为1L的恒容密闭容器中,充人![]() 和
和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
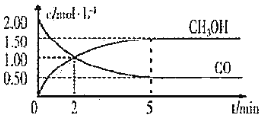
![]() 从反应开始至达到平衡,用氢气表示的平均反应速率
从反应开始至达到平衡,用氢气表示的平均反应速率![]() ______
______![]()
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母序号
填字母序号![]() 。
。
A.达到平衡时,CO的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前![]() 正
正![]() 逆
逆![]() ,2min后
,2min后![]() 正
正![]() 逆
逆![]()
![]() 该条件下反应的平衡常数
该条件下反应的平衡常数![]() ______。
______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com