
����Ŀ����ҵ�����в�����SO2��NOֱ���ŷŽ��Դ������������Ⱦ�����õ绯ѧԭ������SO2��NO��ͬʱ���Na2S2O4��NH4NO3��Ʒ�Ĺ�������ͼ���£�CeΪ��Ԫ�أ��� 
��ش��������⣮
��1��װ�â���NO����������������NO2�������ӷ���ʽ ��
��2�����������H2SO3��HSO3����SO32����������SO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������������ҺpH�Ĺ�ϵ��ͼ1��ʾ�� 
������˵����ȷ���������ţ���
A��pH=7ʱ����Һ��c��Na+����c��HSO3����+c��SO32����
B����ͼ�����ݣ����Թ����H2SO3�ĵڶ�������ƽ�ⳣ��Ka2��10��7
C��Ϊ��þ����ܴ���NaHSO3 �� Ӧ����Һ��pH������4��5Ϊ��
D��pH=9ʱ����Һ��c��OH����=c��H+��+c��HSO4����+c��H2SO4��
����1L1mol/L��NaOH��Һ��ȫ����13.44L������£�SO2 �� ��Ӧ�����ӷ���ʽΪ ��
��ȡװ�â��е�����ҺvmL����cmol/L�����Ը��������Һ�ζ������Ը��������ҺӦװ�������ʽ����ʽ�����ζ����У��жϵζ��յ�ķ����� ��
��3��װ�â������֮һ������Ce4+ �� ��ԭ����ͼ2��ʾ�� ͼ��AΪ��Դ��������������������Ҳ෴Ӧ���з�������Ҫ�缫��ӦʽΪ ��
��4����֪����װ�â�����Һ��NO2����Ũ��Ϊ0.4mol/L��Ҫʹ1m3����Һ�е�NO2����ȫת��ΪNH4NO3 �� ��������װ�â���ͨ���״���µ�O2�����ΪL��
���𰸡�
��1��NO+H2O+Ce4+=Ce3++NO2��+2H+
��2��ABC��3SO2+5OH��=2SO32��+HSO3��+2H2O����ʽ���������һ����Һ���Ϻ�ɫ�Ұ������ɫ����
��3�������������һ����Һ���Ϻ�ɫ�Ұ������ɫ����
��4��4480
���������⣺װ�â��ж�������������������ܺ�ǿ����������֮�䷢����Ӧ��SO2+OH��=HSO3�� �� NO����������֮�䲻�ᷴӦ��װ�â���NO�����������£�NO��Ce4+֮��ᷢ��������ԭ��Ӧ��NO+H2O+Ce4+=Ce3++NO2��+2H+ �� NO+2H2O+3Ce4+=3Ce3++NO3��+4H+ �� װ�â��У��ڵ��۵�����2Ce3+��2e��=2Ce4+ �� �����缫��ӦʽΪ��2HSO3��+2H++2e��=S2O42��+2H2O��װ�â���ͨ�백����������2NO2��+O2++2H++2NH3=2NH4++2NO3�� �� ��1��װ�â���NO������������NO��Ce4+֮��ᷢ��������ԭ��Ӧ��NO+H2O+Ce4+=Ce3++NO2��+2H+ �� NO+2H2O+3Ce4+=3Ce3++NO3��+4H+ �� ���Դ��ǣ�NO+H2O+Ce4+=Ce3++NO2��+2H+����2����A��pH=7ʱ����Һ�����ԣ�c��H+��=c��OH��������Һ�д��ڵ���غ㣺c��H+��+c��Na+��=c��HSO3����+2c��SO32����+c��OH����������Һ��c��Na+��=c��HSO3����+2c��SO32��������A��ȷ��
B��HSO3��SO32��+H+ �� ��ͼ�����ݣ�pH=7ʱ��c��HSO3�� ��=c��SO32�� ������Ka�ı���ʽ��֪��H2SO3�ĵڶ�������ƽ�ⳣ��K2��c��H+��=10��7 �� ��B��ȷ��
C����Һ��pH������4��5ʱ��c��HSO3�� ��Ũ�������Ϊ��þ����ܴ���NaHSO3 �� �ɽ���Һ��pH������4��5���ң���C��ȷ��
D����Һ���������غ㣬ӦΪc��OH����=c ��H+��+c��HSO3����+2c��H2SO3������D����
���Դ��ǣ�ABC����1L1.0mol/L��NaOH��Һ�к����������Ƶ����ʵ���Ϊ��1L��1.0mol/L=1.0mol��13.44L������£�SO2 �� n��SO2��= ![]() =0.6mol��
=0.6mol��
�跴Ӧ�����������Ƶ����ʵ���Ϊx�����Ķ�����������ʵ���Ϊy
2NaOH+ | SO2�T | Na2SO3+H2O |
2 | 1 | 1 |
1.0mol | y | x |
![]() =
= ![]() =
= ![]() ��ã�x=0.5mol y=0.5mol���������������֪�������������ǹ����ģ�ʣ��Ķ�����������ʵ���Ϊ��0.6mol��0.5mol=0.1mol
��ã�x=0.5mol y=0.5mol���������������֪�������������ǹ����ģ�ʣ��Ķ�����������ʵ���Ϊ��0.6mol��0.5mol=0.1mol
���Զ������������ɵ��������Ƽ�����Ӧ��
�������������Ƶ����ʵ���Ϊa���������������Ƶ����ʵ���Ϊb
Na2SO3+H2O+ | SO2�T | 2NaHSO3 |
1 | 1 | 2 |
a | 0.1mol | b |
![]() =
= ![]() =
= ![]() ��ã�a=0.1mol b=0.2mol��
��ã�a=0.1mol b=0.2mol��
����Һ��n��SO32����=0.5mol��0.1mol=0.4mol��n��HSO3����=0.2mol��n��SO32������n��HSO3����=2��1����Ӧ�����ӷ���ʽΪ3SO2+5OH��=2SO32��+HSO3��+2H2
���Դ��ǣ�3SO2+5OH��=2SO32��+HSO3��+2H2O��
����ʽ�ζ���ֻ��ʢ��������Һ����ʽ�ζ���ֻ��ʢ�ż�����Һ�����Ը��������Һ�����ԣ������ʢ������ʽ�ζ����У�ԭ��Һ��ɫ����KMnO4Ϊ�Ϻ�ɫ�����Ե���Һ�е�H2C2O4��KHC2O4��Ӧ��ȫʱ���������һ����Һ���Ϻ�ɫ�Ұ������ɫ���䣻
���Դ��ǣ���ʽ���������һ����Һ���Ϻ�ɫ�Ұ������ɫ���䣻��3������Ce4+Ϊ������Ӧ�������������ϣ��������ʱ���ɵ�Ce4+�ڵ��۵����������ӵ�Դ��������Ӧ����HSO3������ԭ��S2O42�� �� �õ����ӣ��缫��ӦʽΪ��2HSO3��+2H++2e��=S2O42��+2H2O��
���Դ��ǣ�����2HSO3��+2H++2e��=S2O42��+2H2O����4��NO2����Ũ��Ϊ0.4mol/L��Ҫʹ1m3����Һ�е�NO2����ȫת��ΪNH4NO3 �� ��ʧȥ������Ϊ��1000����5��3����0.4mol�������ı���������������V�����ݵ����غ㣺 ![]() ��4=1000����5��3����0.4mol�����V=4480L��
��4=1000����5��3����0.4mol�����V=4480L��
���Դ��ǣ�4480��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о����֣�����ʹ���ҹ�������������������������Ч�ؼ���ȱ����ƶѪ�ķ�����ԭ����������ڳ���ʱ��������������ʳ�ôף�Ч������ã���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ���ش��������⣺
��1����������Һ��ͨ������CO2
�ڼ�ȩ�����Ƶ�Cu��OH��2��Ӧ
��ij�л���Ľṹ��ʽ��ͼ��ʾ��1mol���л���������NaOH��Һ���ȣ���ַ�Ӧ����������NaOH�����ʵ���Ϊmol 
��2�������Ŷ��л���������������ã���Ҳ���ܵ��������ŵ�Ӱ�죮
�ٱȽϷе� ![]()
![]() ���������������=������ͬ��
���������������=������ͬ��
�ڱȽ�ˮ���ԣ� ![]()
![]()
�۱Ƚ����ԣ�CH3COOH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѣ����� ����ѿ�� �۵��� ����ά�� ����֬ ������,������ڵ������·ֱ����ˮ��,��ˮ������ղ���ֻ��1�ֵ���( )
A.�٢ڢۢܢ�
B.�ڢۢ�
C.�ܢ�
D.�ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͼ���ɳ���Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ��A���ɵ���C��D��ȼ�����ɵĵ���ɫ���壮B���������ɫҺ�壬���³�ѹ�£�D��F��K��Ϊ��ɫ�̼�����ζ�����壮H��I��ɫ��Ӧ��Ϊ��ɫ������Ӧ�����ɵIJ�����������ȥ��
��ش��������⣺
��1������A�Ļ�ѧʽΪ ��
��2����Ӧ�ٵ����ӷ���ʽΪ ��
��3����Ӧ�ڵĻ�ѧ����ʽΪ ��
��4������ת��H��I�ķ�Ӧ���ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܸ����ᷴӦ�����ܸ�����������Һ��Ӧ�������ǣ� ��
��Al ��Al2O3 ��NaHCO3 ��Al(OH)3
A. �ۢ�B. �ڢۢ�C. �٢ۢ�D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪SiO2��SO2��CO2���������������ѧ���ʾ���һ���������ԣ�Mg��Na�Ļ�ѧ����Ҳ����һ�������ԣ� I������ͼ��ʾװ�ý���Mg��SO2��Ӧ��ʵ�飮
��1��ѡ����ȡSO2�ĺ����Լ� ��10%��H2SO4��Һ ��70%��H2SO4��Һ
��Na2SO3���� ��CaSO3����
��2��д��װ��B�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ �� װ��C��NaOH��Һ�������� ��
��3����װ�����в���֮������˵�� �� ��ij�о�С������ˡ�ʵ������Si�����о��������Կα�Ϊ�������������ϵõ����¿ɹ��ο���������Ϣ��
��Mg�ڼ��ȵ������¼�����SiO2��Ӧ
�ڽ����軯����ϡH2SO4��Ӧ������������SiH4
��Si��SiO2������ϡH2SO4��Ӧ
��SiH4�ڿ�������ȼ
�������о������м����š���ѡ�ú��ʵ����������˵������³�ַ�Ӧ����������ϡ�����ܽ������Ȼ����ˡ�ϴ�ӡ����������������ϡ�����ܽ�������ʱ�������б������ͻ������Ҳֻ��Ԥ��ֵ��63%���ҡ���
��4����С�顰ʵ������Si���Ļ�ѧ����ʽ�� ��
��5������ơ���ϡ�����ܽ�������ʱ�������б������ͻ���ԭ���ǣ��û�ѧ����ʽ˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������еĺ���ֻ��0.004%�����������������Ѫ�쵰��һ������ȱ�ٵij�Ա���������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬Fe2+�������Σ�����������������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+ �� �������������գ�
��1���������н���Fe2+ ![]() Fe3+��ת��ʱ�����е�Fe2+������
Fe3+��ת��ʱ�����е�Fe2+������
��2��������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+����仰ָ����ά����C����һ��Ӧ��������
��3����С�մ�Ƭ��NaHCO3������θ�ᣨ��Ҫ�ɷ����ᣩ��������ӷ���ʽΪ���������ͬʱ����θ����ʱ��÷���θ��ƽ[��Ҫ�ɷ���Al��OH��3]����Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڽӴ���������������У�SO2ת����SO3ת���ʵĴ�Сֱ�Ӿ�������Ч�ʣ�ij�о�С����ͼ1װ��ģ�����������вⶨSO2ת����SO3��ת���ʣ���֪SO3���۵���16.8�棬�е���44.8�森����װ�������漰��Ӧ�Ļ�ѧ����ʽΪ��Na2SO3��s��+H2SO4��75%��=Na2SO4+SO2��+H2O 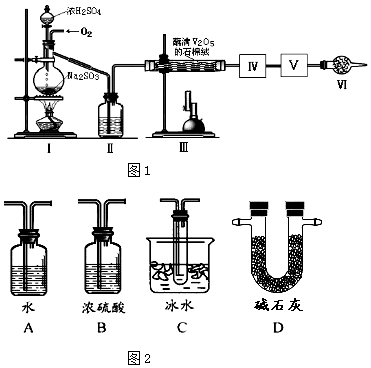
��1�����е��Լ��ǣ�������������Ϊ ��
��2������ʵ����Ҫ��Ӧ���ڢ����������Ӻ��ʵ�װ�ã����ͼ2A��Dװ����ѡ�����ʺ�װ�ò����������������Ŀո��У������������ӵ�װ�÷ֱ����� ��
��3��Ϊ�����SO2��ת���ʣ�ʵ��ʱ�ڣ��ٵμ�Ũ����ڼ��ȴ����IJ����У�Ӧ��ȡ�IJ��������������ţ���
��4��ʵ�������������ռ�SO3���Թܳ���¶���ڿ����У��ܹ������ܿ��д����İ����������������ԭ���� ��
��5����12.6gNa2SO3��ĩ��������Ũ��������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ�����װ�â�������4.48g����ʵ����SO2��ת����Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com