
【题目】某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液中一定含有( )
A.Fe3+B.Cu2+C.Fe2+D.Zn2+
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断锌是( )
A. 负极,被氧化B. 正极,被还原
C. 负极,被还原D. 正极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物CH3﹣CH=CH﹣C≡C﹣CF3分子结构的叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.有5个碳原子可能在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各微粒半径依次增大的是( )
A. Ca2+、K+、Mg2+、Al3+
B. F-、Cl-、Br-、I-
C. Si、Al、Mg、Na
D. Ca2+、K+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:_______________。
(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是__________
(3)控制城市污染源的方法可以有________。
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
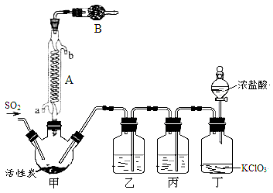
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以F-12 (二氯二氟甲烷)为例):
CF2Cl2![]() CF2Cl+Cl Cl+O3→ClO+O2
CF2Cl+Cl Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯) ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率 B. ClO +ClO![]() ClOOC1的反应中有非极性键的形成
ClOOC1的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂 D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
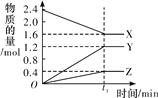
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com