
分析 等物质的量浓度等体积的盐酸溶液和氨水混和,二者恰好反应生成NH4Cl,
(1)NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,但水解程度较小,结合电荷守恒判断离子浓度大小;
(2)铵根离子水解生成一水合氨,但溶液中仍然存在物料守恒;
(3)向混合后的溶液中加入氨水,使c( NH4+)=c(Cl-),结合电荷守恒判断c( H+)、c( OH-)相对大小,从而确定溶液酸碱性.
解答 解:等物质的量浓度等体积的盐酸溶液和氨水混和,二者恰好反应生成NH4Cl,
(1)NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c( H+)>c( OH-);结合电荷守恒得c(Cl-)>c( NH4+),但水解程度较小,所以离子浓度大小顺序为c(Cl-)>c( NH4+)>c( H+)>c( OH-),故答案为:c(Cl-)>c( NH4+)>c( H+)>c( OH-);
(2)铵根离子水解生成一水合氨,但溶液中仍然存在物料守恒c(Cl-)=c(NH4+)+c( NH3.H2O),故答案为:c(Cl-)=c(NH4+)+c( NH3.H2O);
(3)向混合后的溶液中加入氨水,使c( NH4+)=c(Cl-),结合电荷守恒得c( H+)=c( OH-),溶液呈中性,则室温下pH=7,故答案为:=.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意:任何电解质溶液中都存在电荷守恒和物料守恒,与电解质溶液浓度、酸碱性无关,题目难度不大.


科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
下列各组描述正确的是( )
A.化工生产要遵守三原则:充分利用原料、充分利用能量、保护环境.①燃烧时使用沸腾炉②制盐酸时将氢气在氯气中燃烧③制硫酸时使用热交换器 这3种化工生产分别符合以上某原则源:Z#xx#k.Co
B.①用燃烧的方法鉴别甲烷、乙烯和乙炔②用酒精萃取溴水中的溴③用水鉴别硝酸铵和氢氧化钠固体④用互滴法鉴别Na2CO3、盐酸、BaCl2、NaCl四种溶液以上均能达到实验目的
C .①用硫粉覆盖地下撒有的汞②金属钠着火用泡沫灭火器或干粉灭火器扑灭③用热 碱溶液洗去试管内壁的硫④用湿的红色石蕊试纸检验氨气是否集满以上操作均合理
.①用硫粉覆盖地下撒有的汞②金属钠着火用泡沫灭火器或干粉灭火器扑灭③用热 碱溶液洗去试管内壁的硫④用湿的红色石蕊试纸检验氨气是否集满以上操作均合理
D.①过氧化氢:火箭燃料 ②碳酸氢钠:食品发酵剂③钠:制氢氧化钠④硫酸: 制蓄电池以上物质的用途均合理
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
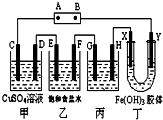 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3在反应中既表现氧化性也表现出酸性 | |
| B. | 每生成22.4 L NO(标准状况)有3 mol电子转移 | |
| C. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原8 mol的HNO3 | |
| D. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原2 mol的HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
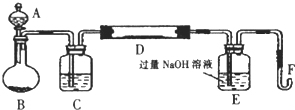
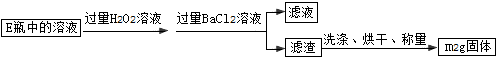
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| D. | SO2溶于水能导电,SO2属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中维生素C作还原剂 | |
| B. | 河虾与其它含维生素C较多蔬菜也不宜同食 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 该反应中砷元素被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com