
分析 (1)①根据草酸和碳酸的电离平衡常数判断酸性强弱,然后利用强酸置换弱酸的原理进行判断;
②A.溶液显示酸性,说明草酸的电离程度大于草酸氢根离子;
B.根据溶液中的电荷守恒判断;
C.根据溶液显示酸性分析;
D.根据溶液中的物料守恒判断;
(2)①根据酸性高锰酸钾溶液为酸性、具有强氧化性分析;
②根据滴定结束前为无色,滴定结束后为紫色判断滴定终点;
③发生反应为2MnO4-+5C2O42-+16H+=10CO2↑+2Mn2++8H2O,根据滴定操作对c=$\frac{c(标准)×V(标准)}{V(标准)}$的影响分析;
④先计算出20mL样品溶液消耗高锰酸钾的物质的量,再计算出100mL样品溶液消耗高锰酸钾的物质的量,然后根据反应计算出消耗草酸钠的物质的量,根据m=nM计算出1g草酸钠样品中含有草酸钠的质量,最后计算出样品的纯度.
解答 解:(1)根据25℃H2C2O4 K1=5.4×10-2、K2=5.4×10-5,H2CO3 K1=4.5×10-7、K2=4.7×10-11可知酸性大小为:H2C2O4>HC2O4->H2CO3>HCO3-,
①A.酸性HC2O4->H2CO3,则草酸与碳酸根离子反应生成二氧化碳气体和草酸根离子,正确的反应为:H2C2O4+CO32-=CO2↑+H2O+C2O42-,故A错误;
B.HC2O4->H2CO3>HCO3-,草酸氢根离子少量时,发生反应:HC2O4-+CO32-=HCO3-+C2O42-,故B正确;
C.酸性HC2O4->H2CO3,草酸与碳酸根离子反应生成二氧化碳气体和草酸根离子:H2O+CO2+C2O42-?=HC2O4-?+HCO3-不会反应,故错误;
D.酸性HC2O4->H2CO3,碳酸无法置换出草酸氢根离子,该反应C2O42-+CO2+H2O═H2C2O4+CO32-不会发生,故D错误;
故答案为:B;
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液,反应后溶质为等浓度的H2C2O4和NaHC2O4,混合溶液中c(H+)>c(OH-),
A.草酸的电离程度大于HC2O4-的电离,则溶液中c(H2C2O4)<c(HC2O4-),故A错误;
B.根据电荷守恒可得:c(Na+)+c(H+)═2c(C2O42-)+c(HC2O4-)+c(OH-),故B正确;
C.溶液呈酸性:c(OH-)<c(H+),则c(OH-)<c(H+)+2c(H2C2O4)+c(HC2O4-),故C错误;
D.根据物料守恒可得:c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.01mol/L,故D错误;
故答案为:B;
(2)①酸性高锰酸钾溶液呈酸性,且具有强氧化性,能够氧化碱式滴定管的橡胶管,所以应该用酸式滴定管量取,
故答案为:酸式;
②滴定结束前溶液为无色,滴定结束后溶液层紫色,所以滴定终点的现象为:无色变为紫色(紫红色),且半分钟内不褪色,
故答案为:无色变为紫色(紫红色),且半分钟内不褪色;
③A.盛装的Na2C2O4的滴定管没润洗,导致待测液浓度减小,则测定结果偏小,故A错误;
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏高,故B正确;
C.读数时滴定前仰视,滴定后俯视,读出的高锰酸钾溶液体积偏小,测定结果偏低,故C错误;
D.锥形瓶中残留少量水,对测定结果无影响,故D错误;
故答案为:B;
④25.00mL 0.016mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.016mol/L×0.025L=0.0004mol,100mL该样品溶液完全反应消耗高锰酸钾的物质的量为:0.0004mol×$\frac{100mL}{20mL}$=0.002mol,根据反应2MnO4-+5C2O42-+16H+=10CO2↑+2Mn2++8H2O可知,1gNa2C2O4固体样品中含有草酸钠的物质的量为:0.002mol×$\frac{5}{2}$=0.005mol,质量为:134g/mol×0.005mol=0.67g,
所以Na2C2O4的纯度为:$\frac{0.67g}{1g}$×100%=67%,
故答案为:67%.
点评 本题考查了探究物质组成方法,题目难度中等,涉及中和滴定、离子浓度大小比较、溶液酸性强弱比较等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
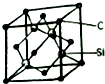 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 是地壳中含量最高的金属元素 |
| D | A、B、D组成的化合物X是84消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料,有着重要的用途和应用前景.
甲醇是一种重要的化工原料,有着重要的用途和应用前景.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com