
| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
分析 A.先计算出60s内用Z表示的反应速率,然后利用化学计量数关系计算出60s内以X浓度变化表示的反应速率;
B.容器体积增大一倍,容器内压强实现,平衡向着逆向移动,则Z的浓度大于原先的一半;
C.增大压强,平衡向着正向移动,Y的转化率增大;
D.升高温度后,平衡向着吸热的反应方向一定,X的体积分数增大,则平衡向着逆向移动,逆反应为吸热反应.
解答 解:A.达到平衡时Z的平均反应速率为:v(Z)=$\frac{\frac{0.3mol}{10L}}{60s}$=0.0005mol/(L•s),反应速率与化学计量数成正比,则60s内以X浓度变化表示的反应速率为:v(X)=2v(Z)=0.001 mol/(L•s),故A正确;
B.将容器容积变为20L时,物质的压强减小,平衡向体积增大的方向移动,即逆向移动,Z的物质的量减小,即小于0.3mol,Z的新平衡浓度将小于原平衡浓度的$\frac{1}{2}$,故B错误;
C.增大压强后,平衡向着正反应方向移动,则Y的转化率增大,故C错误;
D.若升高温度,X的体积分数增大,说明逆反应为吸热反应,则正反应为放热反应,故D错误;
故选A.
点评 本题主要考查化学平衡的影响及其应用,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
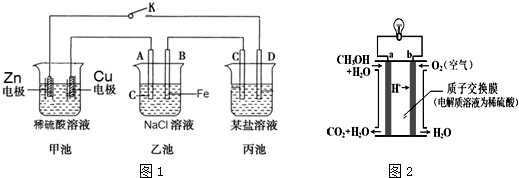
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
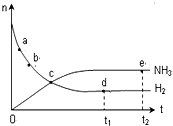 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d (t1时刻)和点e (t2时刻)处n(N2)不一样 | |
| D. | 若开始充入1mol N2及足量H2,提供适当条件,可得2mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
| B | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
| C | 室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 | 验证BaSO4和BaCO3的Ksp的相对大小 |
| D | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
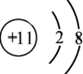 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com