
| A. | 用碳酸钠溶液可以洗涤油污 | B. | 用pH试纸可以测定土壤的酸碱性 | ||
| C. | 用明矾可以对自来水杀菌病毒 | D. | 含氟牙膏可以有效防止龋齿 |
分析 A.碳酸钠溶液显碱性;
B.pH试纸可以用于测定溶液的pH;
C.明矾没有强氧化性不能杀菌消毒;
D.F元素是牙齿中的重要组成元素.
解答 解:A.碳酸钠溶液显碱性,油脂在碱性条件下易水解,所以用碳酸钠溶液可以洗涤油污,故A正确;
B.pH试纸可以用于测定溶液的pH,则用pH试纸可以测定土壤的酸碱性,故B正确;
C.明矾没有强氧化性不能杀菌消毒,明矾在溶液中水解生成氢氧化铝胶体能吸附水中的悬浮颗粒能净水,故C错误;
D.F元素是牙齿中的重要组成元素,所以使用含氟牙膏可以有效防止龋齿,故D正确.
故选C.
点评 本题考查较为综合,涉及盐的水解、钝化、pH试纸、胶体的应用等知识,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:多选题
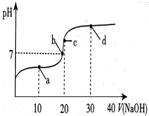 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
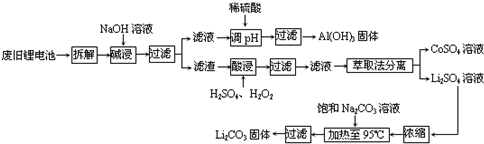
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
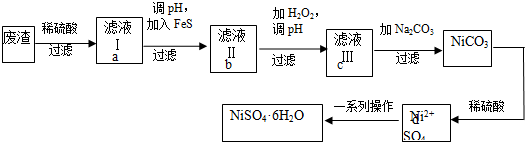
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量多 | |
| D. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com