
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:

(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__。
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 2Fe+3Cl2![]() 2FeCl3 Cu+2H2SO4 (浓)
2FeCl3 Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO
CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO![]() +4H+ Cl2+SO2+2H2O=4H++SO
+4H+ Cl2+SO2+2H2O=4H++SO![]() +2Cl-
+2Cl-
【解析】(1)MnO2与浓盐酸反应生成MnCl2和Cl2,Mn元素化合价由+4价降低为+2价,盐酸中Cl元素化合价降为0价,根据元素守恒,反应有水生成,可得MnO2+HCl(浓) —MnCl2+Cl2↑+H2O,根据化合价升降守恒配平方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)粗铜中含有少量铁,通入Cl2,将Cu氧化为CuCl2,将Fe氧化为FeCl3,生成FeCl3的反应方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)铜和浓硫酸反应制SO2,反应方程式为Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)将CuCl2、FeCl3固体溶解后,再将铁离子转化为红褐色的氢氧化铁沉淀,过滤除铁,得到溶液CuCl2。向溶液中通入SO2,生成目标产物CuCl,Cu元素化合价降低,被还原,则SO2被氧化为SO42-,离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(5)若将等物质的量的SO2、Cl2通入水中,恰好完全反应生成硫酸和盐酸,所得溶液没有漂白性,离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-。
【题型】综合题
【结束】
23
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,为黑色磁性氧化物, E为常见的强碱。

(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
【答案】 Al2O3 2Al+2OH—+2H2O=2AlO![]() +3H2↑ 2Fe2++Cl2=2Fe3++2Cl-
+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- ![]()
【解析】M为气体单质,且M能使带火星的木条复燃,则M为O2;D可作耐高温材料,则D可能为高熔点的Al2O3或MgO;B为黑色磁性氧化物,则B为Fe3O4。“A+B→C+D”,A、C为单质,B、D为金属氧化物,则该反应为高温条件下金属间的置换反应,则A、C为金属单质,B为Fe3O4,可知C为Fe;E为强碱,A为金属单质,A与E反应生成气体单质G,所以A为两性金属Al,D为Al2O3,G为H2。“G+K→L”,G为H2,K为气体单质,L+B(Fe3O4)→F+H,又“F+E(强碱)→I”,则可推测F中含有铁的阳离子,与强碱反应生成沉淀;逆推L应为酸,两种单质化合得到的酸,则K为Cl2,L为HCl;Fe3O4溶于盐酸生成FeCl2和FeCl3;根据F+K(Cl2)→H,可得F为FeCl2,H为FeCl3;沉淀I+M(O2)→J,则沉淀I为Fe(OH)2,J为Fe(OH)3。
(1)根据上述分析,D为Al2O3;
(2)反应①为Al与强碱反应生成AlO2-和H2,离子方程式为2Al+2OH—+2H2O=2AlO2-+3H2↑;
(3)反应②为FeCl2+ Cl2→FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)反应③为Fe(OH)2被氧气氧化为Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;其中4mol Fe(OH)2失去4mol电子,氧气得电子,故单线桥可表示为:![]() 。
。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A. 18 g H2O所含的分子数为NAB. 22.4 L H2O所含的分子数为NA
C. NA个氢原子的质量为2 gD. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂.以生物质废液﹣﹣木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3CaCO3 , 含SiO2等杂质)等为原料生产CMA的实验流程如图1: 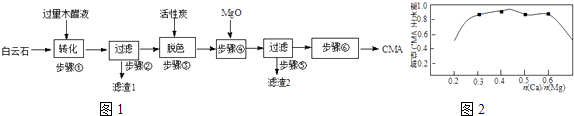
(1)步骤①发生的反应离子方程式为 .
(2)步骤②所得滤渣1的主要成分为(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 .
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图2所示,步骤④的目的除调节n(Ca):n(Mg)约为(选填:1:2;3:7;2:3)外,另一目的是 .
(4)步骤⑥包含的操作有、过滤、洗涤及干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是乙醇燃料电池的实验装置图,下列有关说法一定正确的是( ) 
A.若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极
B.甲池中负极的电极反应式为:CH3CH2OH﹣12e﹣+3H2O=2CO2+12H+
C.甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g
D.M电极上的电极反应式为:Ag++e﹣=Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应:Z(?)+W(?)X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( ) 
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)配制时必须的玻璃仪器有:烧杯、玻璃棒、 、 。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)下列配制的溶液浓度偏低的是 ;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
(4)某同学改用固体Na2CO3配制Na2CO3溶液的过程如图所示,其错误操作序号是 

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R′CH2Cl ![]() RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如:
RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如: ![]()
![]()
![]()
③ ![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示: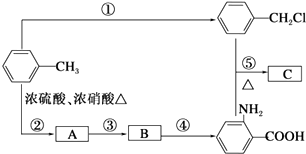
请回答下列问题:
(1)B物质的结构简式是 .
(2)写出反应①、②的化学方程式: ①;
② .
(3)反应①~⑤中,属于取代反应的是(填反应序号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com