
����Ŀ��
��1������ʱ����IJ��������У��ձ����������� �� ��
��2������ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�Σ� ��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B������ƽȷ��ȡ�����NaOH����������������ˮ��Լ30mL�����ò���������������ʹ�����ܽ�
C��������ȴ��NaOH��Һ�ز�����ע��250mL������ƿ��
D��������ƿ�ǽ����ߵ�ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
��3���������Ƶ���ҺŨ��ƫ�͵��� ��
A������NaOHʱ���������������
B��������ƿ��ת����Һʱ(ʵ�鲽��C)������Һ����������ƿ����
C��������ˮʱ���������˿̶���
D������ʱ���ӿ̶���
E������ǰ������ƿ������������ˮ
��4��ijͬѧ���ù���Na2CO3����Na2CO3��Һ�Ĺ�����ͼ��ʾ��������������� 

���𰸡���1�� 250 ml ����ƿ ��ͷ�ι� ��2�� BCAFED ��3�� ABC ��4�� �٢�
�������������������1������ʵ������IJ����Լ�ÿ��������Ҫ����ȷ����Ӧ��������������250mL��Һ����ѡ������ƿ�Ĺ��Ϊ250mL������ʱ�����м��㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ��NaOHӦ�����ձ��г��������ձ����ܽⲢ�ò��������裬��ȴ��ת�Ƶ�250mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ������Ϊ��ƽ��ҩ�ס��ձ���250mL����ƿ������������ͷ�ιܣ������������ձ���250mL����ƿ������������ͷ�ιܡ�
��2������ʵ�鲽���������֪��˳��ΪBCAFED
��3���������������ʵ����ʵ��������Һ�������Ӱ�죬����c=n/V������A������NaOHʱ��������������̣����ʵ��������٣�Ũ��ƫ�ͣ���ȷ��B��������ƿ��ת����Һʱ������Һ����������ƿ���棬���ʵ��������٣�Ũ��ƫ�ͣ���ȷ��C��������ˮʱ���������˿̶��ߣ���Һ���ƫ��Ũ��ƫ�ͣ���ȷ��D������ʱ���ӿ̶��ߣ���Һ���ƫС��Ũ��ƫ�ߣ�����E������ǰ������ƿ������������ˮ����Ӱ�죬Ũ�Ȳ��䣬����
��4��������Na2CO3ʱ��������������̣�������ʱ���ӿ̶��ߡ�


 �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д� ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��ơ�����ͭ���仯���������Ҫ���塣
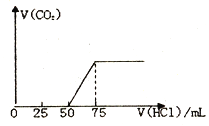
��1����50mLNaOH��Һ����������ͨ��һ������CO2���������Һ�������0.1mol/L���ᣬ����������CO2���(��״����) �����������������֮��Ĺ�ϵ��ͼ��ʾ:
�Լ���:
��1����NaOH ��Һ��ͨ��CO2�����������Һ�е�������_______����Ӧ������CO2�������(��״��) ��_______L��
��2����Ba (OH)2��Һ�У���μ���NaHSO4��Һ��ǡ�ò������ɳ���Ϊֹ��д��������Ӧ�����ӷ���ʽ_______________������������Ӧ����Һ�м����μ�NaHSO4��Һ��д���˲���Ӧ�����ӷ���ʽ: _______________ ��
��3��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж���ij������Һ�У�����2%~5%��NaNO2 ֱ���ŷŻ������Ⱦ�������Լ���ʹNaNO2ת��Ϊ�����������Ⱦ��N2����_____��
A.KMnO4 B.NH4Cl C.O2 D.HNO3
��4����Fe(NO3)3�� Cu(NO3)2��HNO3 ��ϡ��Һ���������ۣ�c(Fe2+)�ı仯��ͼ��ʾ��
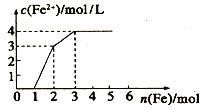
��������0~1�η�Ӧ�����ӷ���ʽΪ:_____________��
��������Һ����ı仯����ԭ��ҺCu(NO3)2��Ũ��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧ�ȵ���������ȷ���ǣ� �� ����֪2H2��g��+O2��g���T2H2O��g����H=��483.6kJmol��1 �� ��������ȼ����Ϊ��H=��241.8kJmol��1
���ɵ���Aת��Ϊ����B��һ�����ȹ��̣��ɴ˿�֪����B�ȵ���A�ȶ�
��X��g��+Y��g���TZ��g��+W��s����H��0�����º��������´ﵽƽ������X��������Ӧ�ġ�H����
����֪��
���ۼ� | C��C | C�TC | C��H | H��H |
����/��kJmol��1�� | 348 | 610 | 413 | 436 |
�ϱ����ݿ��Լ���� ![]() ��g��+3H2��g����
��g��+3H2��g���� ![]() ��g���ķ�Ӧ�ȣ�
��g���ķ�Ӧ�ȣ�
���ɸ�˹���ɣ���֪����ͬ�����£����ʯ��ʯīȼ������1molCO2����ʱ���ų���������ȣ�
��25�棬101kPaʱ��1mol̼��ȫȼ������CO2���ų�������Ϊ̼��ȼ���ȣ�
A.�٢ڢۢ�
B.�ۢܢ�
C.�ܢ�
D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮAlCl3���������������л��ϳɵĴ����ȣ���ҵ������������Ҫ�ɷ���Al2O3��Fe2O3 �� ������������SiO2 ����ʯ�ͽ�����Ҫ�ɷ���C��Ϊԭ���Ʊ���ˮAlCl3��2Al2O3+6Cl2�T4AlCl3+3O2
�ش��������⣺
��1�����뽹̿��Ļ�ѧ��Ӧ�ɱ�ʾΪAl2O3+C+Cl2 ![]() AlCl3+X�������ʵ��ȷ������X�ijɷ֣� ��
AlCl3+X�������ʵ��ȷ������X�ijɷ֣� ��
��2�����ᴿAlCl3�ֲ�Ʒʱ��������������ۣ���ʹ�۵�ϵ͵�FeCl3ת��Ϊ�۵�ϸߵ�FeCl2 �� �Ӷ�������AlCl3�л��������Ȼ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ����FeCl3���ʣ��Ĵ��ȣ���ȡ16.25g��ˮAlCl3��Ʒ�����ڹ�����NaOH��Һ�����˳�����������ᆳϴ�ӡ����ա���ȴ�����أ�������������Ϊ0.32g��
�ٹ����漰�����ӷ���ʽ�� ��
��AlCl3��Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��Ȼ���ͭ��һ��������ˮ�İ�ɫ���������������£�

��1������ӦI���ڼ��������½��У�ͬʱ��MnCl2���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ __��
��2�� ����Ӧ����������Cl2��Ӧ�Ļ�ѧ����ʽΪ__�� ��ʵ������SO2�������ͭ��Ũ���ᷴӦ�Ƶã��÷�Ӧ�Ļ�ѧ����ʽΪ__��
��4������Ӧ�������ӷ���ʽΪ___��
��5�����������ʵ�����S02��Cl2ͨ��ˮ�У�������Һ����û��Ư���ԣ��÷�Ӧ�����ӷ���ʽΪ___��
���𰸡� MnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O 2Fe��3Cl2
MnCl2��Cl2����2H2O 2Fe��3Cl2![]() 2FeCl3 Cu��2H2SO4 (Ũ)
2FeCl3 Cu��2H2SO4 (Ũ) ![]() CuSO4��SO2����2H2O SO2��2Cu2+��2Cl����2H2O��2CuCl����SO
CuSO4��SO2����2H2O SO2��2Cu2+��2Cl����2H2O��2CuCl����SO![]() ��4H+ Cl2��SO2��2H2O��4H+��SO
��4H+ Cl2��SO2��2H2O��4H+��SO![]() ��2Cl��
��2Cl��
����������1��MnO2��Ũ���ᷴӦ����MnCl2��Cl2��MnԪ�ػ��ϼ���+4�۽���Ϊ+2�ۣ�������ClԪ�ػ��ϼ۽�Ϊ0�ۣ�����Ԫ���غ㣬��Ӧ��ˮ���ɣ��ɵ�MnO2��HCl(Ũ) ��MnCl2��Cl2����H2O�����ݻ��ϼ������غ���ƽ����ʽ��MnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O��
MnCl2��Cl2����2H2O��
��2����ͭ�к�����������ͨ��Cl2����Cu����ΪCuCl2����Fe����ΪFeCl3������FeCl3�ķ�Ӧ����ʽΪ2Fe��3Cl2![]() 2FeCl3��
2FeCl3��
��3��ͭ��Ũ���ᷴӦ��SO2����Ӧ����ʽΪCu��2H2SO4 (Ũ) ![]() CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��
��4����CuCl2��FeCl3�����ܽ���ٽ�������ת��Ϊ���ɫ�������������������˳������õ���ҺCuCl2������Һ��ͨ��SO2������Ŀ�����CuCl��CuԪ�ػ��ϼ۽��ͣ�����ԭ����SO2������ΪSO42�������ӷ���ʽΪSO2��2Cu2+��2Cl����2H2O��2CuCl����SO42����4H+��
��5�����������ʵ�����SO2��Cl2ͨ��ˮ�У�ǡ����ȫ��Ӧ������������ᣬ������Һû��Ư���ԣ����ӷ���ʽΪCl2��SO2��2H2O��4H+��SO42����2Cl����
�����͡�������
��������
23
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ����Ӧ�в�����������ȥ����A��C��G��K��M Ϊ����������G��K��L��M Ϊ���壬����M��ʹ�����ǵ�ľ����ȼ��D���������²��ϣ�Ϊ��ɫ��������� EΪ������ǿ�

��1��D�Ļ�ѧʽΪ__��
��2��д����Ӧ�������ӷ���ʽ��__��
��3��д����Ӧ�������ӷ���ʽ��__��
��4��д����Ӧ���Ļ�ѧ����ʽ�����õ����ű�ʾ����ת�Ƶķ������Ŀ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.NaOH��Mg(OH)2.��Al(OH)3�ļ�������
B.Si��P��S��Clԭ�Ӱ뾶��С
C.C��N��O��F�����������
D.K��Na��Mg��Al����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����Ũ��Ϊa mol/L�ı�����ȥ�ⶨV mL NaOH��Һ�����ʵ���Ũ�ȣ�����д���пհף�
��1����ʽ�ζ���������ˮϴ����Ӧ�ý��еIJ����� ��
��2����ͼ����ʽ�ζ�����Һ���ڵζ�ǰ��Ķ�������c ��NaOH��=moL/L�� 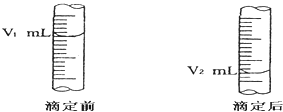
��3�����ڵζ�ǰ�ζ��ܼ��첿���������ݣ��ζ���ζ��ܼ��첿��������ʧ����ⶨ��NaOH���ʵ���Ũ�Ȼ�ƫ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����ӵ��Լ��ͷ�����
�Լ� | �� �� | |
�����л���������ϩ | ||
���л��������ױ� | ||
�Ҵ��л�������ˮ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com