
【题目】研究钠、铁、铜及其化合物具有重要意义。
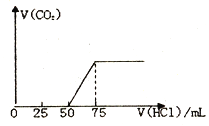
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
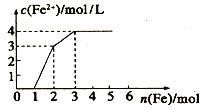
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
【答案】 NaOH和Na2CO3 0.056L Ba2++OH-+H++SO42-=BaSO4↓+H2O OH-+H+=H2O B Fe+NO3-+4H+=Fe3++NO↑+2H2O 1mol/L
【解析】(1)图中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1;根据反应NaHCO3+HCl= NaCl+CO2↑+H2O可知n(CO2)=n(HCl)= 0.1mol/L×0.025L=0.0025mol,V(CO2)= 0.0025mol×22.4L/mol=0.056L;(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,以硫酸根离子与钡离子按1:1进行反应,发生反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,若在上述反应后溶液中继续滴加NaHSO4溶液,溶液中未反应的氢氧根离子继续与NaHSO4电离出的氢离子反应,反应的离子方程式为:OH-+H+=H2O;(3)含有2%~5%的NaNO2的溶液直接排放会造成污染,若试剂能使NaNO2转化为不引起二次污染的N2,则物质应该有还原性,加入的物质是NH4Cl,选项是B;
(4)Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液氧化性为HNO3>Fe3+>Cu2+,金属铁先和氧化性强的离子反应。①横坐标0~1段是金属铁和硝酸之间的反应,发生反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,所以亚铁离子的浓度不变;②0~1:开始阶段是金属铁和硝酸之间的反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,当加入金属铁1mol是,生成三价铁离子是1mol,所以亚铁离子的浓度不变;1~2:金属铁和硝酸反应结束后,生成1mol的三价铁离子,然后发生反应Fe+2Fe3+=3Fe2+,此时加入的1mol铁会和三价铁反应生成3mol亚铁离子,此时c(Fe2+)=3mol/L,说明溶液的体积为1L;2~3:反应的最后阶段为:Fe+Cu2+=Fe2++Cu,所有的离子均被还原,此时加入的1mol铁会和Cu2+反应生成1mol亚铁离子;则n(Cu2+)=1mol;c(Cu2+)=![]() =1mol/L。
=1mol/L。


科目:高中化学 来源: 题型:
【题目】下列各项有机化合物的命名或分类正确的是( )
A.2,3﹣二甲基﹣2﹣乙基己烷
B.CH3CH2CH2Cl 氯丙烷
C.![]() 属于芳香化合物
属于芳香化合物
D.![]() 属于羧酸
属于羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下各组离子因发生氧化还原反应而不能大量共存的是( )
A. Ca2+、H+、SO42-、HCO3-B. H+、Fe2+、SO42-、 NO3-
C. Na+、Cu2+、Cl-、S2-D. Fe3+、K+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4LCO2含有的分子数为1NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A. 18 g H2O所含的分子数为NAB. 22.4 L H2O所含的分子数为NA
C. NA个氢原子的质量为2 gD. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是( )
A.淀粉、纤维素都属于糖类且互为同分异构体
B.戊烷(C5H12)有三种同分异构体
C.乙醇、乙酸、葡萄糖均能发生酯化反应
D.福尔马林、医用酒精均能使蛋白质变性,可用作消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)(填“=”、“>”或“<”)NH4HSO4中c(NH4+).
(2)如图一是0.1molL﹣1电解质溶液的pH随温度变化的图象. 
①其中符合0.1molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②室温时,0.1molL﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=
molL﹣1(填数值)
(3)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示.试分析图中a、b、c、d四个点,水的电离程度最大的是;在c点,溶液中各离子浓度由大到小的排列顺序是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)配制时必须的玻璃仪器有:烧杯、玻璃棒、 、 。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)下列配制的溶液浓度偏低的是 ;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
(4)某同学改用固体Na2CO3配制Na2CO3溶液的过程如图所示,其错误操作序号是 

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com