
【题目】下列关于有机物的叙述不正确的是( )
A.淀粉、纤维素都属于糖类且互为同分异构体
B.戊烷(C5H12)有三种同分异构体
C.乙醇、乙酸、葡萄糖均能发生酯化反应
D.福尔马林、医用酒精均能使蛋白质变性,可用作消毒剂
科目:高中化学 来源: 题型:
【题目】常温常压下,将盛有20mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( )
A.17.8 mL
B.14.8 mL
C.12.6 Ml
D.12.4 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如图所示,有关说法正确的是( ) 
A.在化学反应中, ![]() H2O可转变为D2O
H2O可转变为D2O
B.“加碘食盐”生产中碘添加剂为单质I2
C.实验室用带玻璃塞的棕色瓶贮存液Br2
D.电解饱和MgCl2溶液时在阴极得到Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究钠、铁、铜及其化合物具有重要意义。
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
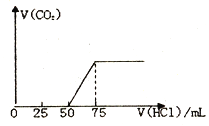
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
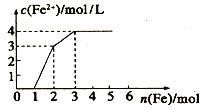
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl--浓度由大到小的顺序是( )
①200 mL 2 mol/L MgCl2溶液 ②1000 mL 2.5mol/L NaCl溶液 ③300 mL 5 mol/L KCl溶液 ④250 mL 1 mol/LFeCl3溶液
A. ②③①④ B. ④①②③ C. ①④②③ D. ③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]强热可发生反应:3K4[Fe(CN)6] ![]() 2 (CN)2↑+12KCN+N2↑+Fe3C+C
2 (CN)2↑+12KCN+N2↑+Fe3C+C
(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态核外电子排布式为 .
(2)(CN)2分子中碳原子杂化轨道类型为;1mol(CN)2分子中含有σ键的数目为 .
(3)O ![]() 与CN﹣互为等电子体,则O
与CN﹣互为等电子体,则O ![]() 的电子式为 .
的电子式为 .
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH+SO2=Na2SO3+H2O …(a)
Na2SO3+H2O+SO2=2NaHSO3…(b)
2NaHSO3 ![]() Na2S2O5+H2O …(c)
Na2S2O5+H2O …(c)
实验装置如下: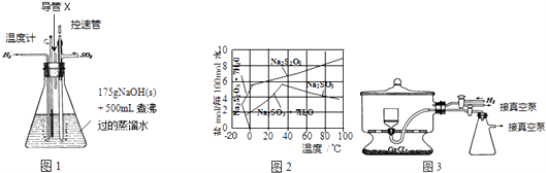
(1)实验室可用废铝丝与NaOH溶液反应制取H2 , 制取H2的离子方程式为 .
(2)图1装置中,导管X的作用是 .
(3)通氢气一段时间后,以恒定速率通入SO2 , 开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为;
实验后期须保持温度在约80℃,可采用的加热方式为 .
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图2溶解度曲线,除去其中亚硫酸钠固体的方法是;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 .
(5)用图3装置干燥Na2S2O5晶体时,通入H2的目的是;真空干燥的优点是 .
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52﹣+2I2+3H2O=2SO42﹣+4I﹣+6H+;2S2O32﹣+I2=S4O62﹣+2I﹣
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点.
④ .
⑤ .
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.NaOH、Mg(OH)2.、Al(OH)3的碱性逐渐减弱
B.Si、P、S、Cl原子半径逐渐减小
C.C、N、O、F最高正价逐渐减弱
D.K、Na、Mg、Al金属性逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com