
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)(填“=”、“>”或“<”)NH4HSO4中c(NH4+).
(2)如图一是0.1molL﹣1电解质溶液的pH随温度变化的图象. 
①其中符合0.1molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②室温时,0.1molL﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=
molL﹣1(填数值)
(3)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示.试分析图中a、b、c、d四个点,水的电离程度最大的是;在c点,溶液中各离子浓度由大到小的排列顺序是 . 
【答案】
(1)>
(2)I;10﹣3
(3)a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+)
【解析】解:(1)NH4Al(SO4)2水解显酸性,NH4HSO4主要是因为完全电离出的H+显酸性,故pH相同的NH4Al(SO4)2的浓度须远大于大于NH4HSO4溶液的浓度,则NH4Al(SO4)2中c(NH4+) 大于NH4HSO4中c(NH4+),所以答案是:>;(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为I,所以答案是:I;②根据电荷守恒,可以求出2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=c(H+)﹣c(OH﹣)=10﹣3 molL﹣1[c(OH﹣)太小,可忽略],所以答案是:10﹣3;(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+ , 溶液中只有(NH4)2SO4与Na2SO4 , (NH4)2SO4的水解对水的电离有促进作用;而b、c、d三点溶液均含有NH3H2O,而NH3H2O抑制水的电离,故a点溶液中水的电离程度最大;c点溶液呈碱性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,b点时c(Na+)>c(SO42﹣),根据N元素与S元素的关系,可以得出c(SO42﹣)>c(NH4+),故c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+),所以答案是:a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+).


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列过程中,只包含物理过程的是( )
A.蛋白质溶液中加入饱和(NH4)2SO4溶液B.石灰粉刷的墙壁日久变硬
C.自来水生产时的“沉降”过程D.用“氧立得”制取氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究钠、铁、铜及其化合物具有重要意义。
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
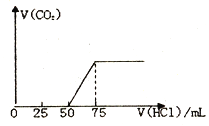
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
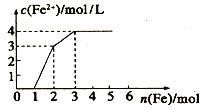
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]强热可发生反应:3K4[Fe(CN)6] ![]() 2 (CN)2↑+12KCN+N2↑+Fe3C+C
2 (CN)2↑+12KCN+N2↑+Fe3C+C
(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态核外电子排布式为 .
(2)(CN)2分子中碳原子杂化轨道类型为;1mol(CN)2分子中含有σ键的数目为 .
(3)O ![]() 与CN﹣互为等电子体,则O
与CN﹣互为等电子体,则O ![]() 的电子式为 .
的电子式为 .
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH+SO2=Na2SO3+H2O …(a)
Na2SO3+H2O+SO2=2NaHSO3…(b)
2NaHSO3 ![]() Na2S2O5+H2O …(c)
Na2S2O5+H2O …(c)
实验装置如下: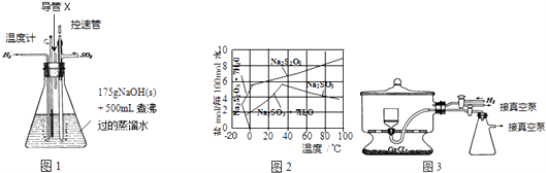
(1)实验室可用废铝丝与NaOH溶液反应制取H2 , 制取H2的离子方程式为 .
(2)图1装置中,导管X的作用是 .
(3)通氢气一段时间后,以恒定速率通入SO2 , 开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为;
实验后期须保持温度在约80℃,可采用的加热方式为 .
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图2溶解度曲线,除去其中亚硫酸钠固体的方法是;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 .
(5)用图3装置干燥Na2S2O5晶体时,通入H2的目的是;真空干燥的优点是 .
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52﹣+2I2+3H2O=2SO42﹣+4I﹣+6H+;2S2O32﹣+I2=S4O62﹣+2I﹣
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点.
④ .
⑤ .
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( ) ①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3 , 还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2═4AlCl3+3O2
回答以下问题:
(1)加入焦炭后的化学反应可表示为Al2O3+C+Cl2 ![]() AlCl3+X↑,设计实验确定气体X的成分: .
AlCl3+X↑,设计实验确定气体X的成分: .
(2)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2 , 从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为 .
(3)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①过程涉及的离子方程式、 .
②AlCl3产品的纯度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是 .
(2)如图是酸式滴定管中液面在滴定前后的读数:则c (NaOH)=moL/L. 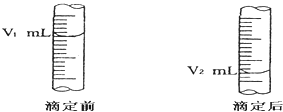
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com