
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. ![]()
![]()
![]() B.
B. ![]()
![]()
![]()
C. ![]()
![]()
![]() D.
D. ![]()
![]()
![]()
【答案】C
【解析】A项,反应Fe+CuSO4=FeSO4+Cu属于置换反应,Fe元素的化合价由0价升至+2价,Cu元素的化合价由+2价降至0价,属于氧化还原反应;B项,反应AgNO3+NaCl=AgCl↓+NaNO3属于复分解反应,反应前后元素的化合价没有变化,不属于氧化还原反应;C项,反应Fe2O3+3CO![]() 2Fe+3CO2是由两种化合物反应生成一种单质和一种化合物,不属于四种基本反应类型,Fe元素的化合价由+3价降至0价,C元素的化合价由+2价升至+4价,属于氧化还原反应;D项,2KMnO4
2Fe+3CO2是由两种化合物反应生成一种单质和一种化合物,不属于四种基本反应类型,Fe元素的化合价由+3价降至0价,C元素的化合价由+2价升至+4价,属于氧化还原反应;D项,2KMnO4![]() K2MnO4+MnO2+O2↑属于分解反应,Mn元素的化合价由KMnO4中的+7价降至K2MnO4中的+6价和MnO2中的+4价,O元素的化合价由-2价升至O2中的0价,属于氧化还原反应;符合题意的为C,答案选C。
K2MnO4+MnO2+O2↑属于分解反应,Mn元素的化合价由KMnO4中的+7价降至K2MnO4中的+6价和MnO2中的+4价,O元素的化合价由-2价升至O2中的0价,属于氧化还原反应;符合题意的为C,答案选C。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.00 mL,则该样品中N的含量为________(保留两位小数)。[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫和二氧化碳的下列说法中不正确的是( )
A. 都是酸性氧化物B. 都具有氧化性
C. 都能使澄清石灰水变浑浊D. 都能与氯化钙溶液反应生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究钠、铁、铜及其化合物具有重要意义。
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
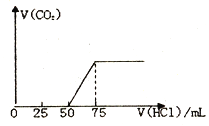
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
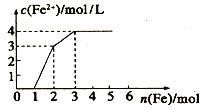
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:CO2(g)+H2S(g)COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10﹣3 |
下列说法正确的是( )
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10﹣3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]强热可发生反应:3K4[Fe(CN)6] ![]() 2 (CN)2↑+12KCN+N2↑+Fe3C+C
2 (CN)2↑+12KCN+N2↑+Fe3C+C
(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态核外电子排布式为 .
(2)(CN)2分子中碳原子杂化轨道类型为;1mol(CN)2分子中含有σ键的数目为 .
(3)O ![]() 与CN﹣互为等电子体,则O
与CN﹣互为等电子体,则O ![]() 的电子式为 .
的电子式为 .
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( ) ①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com