
����Ŀ���̷��е����ʺ����IJⶨ�������������϶�����������ԭ����ʳƷ������ʹ���һͬ���ȣ�ʹ�����ʷֽ⣬�ֽ�İ�����������������李�Ȼ������ʹ�����룬���������պ�����������������Һ�ζ�������������������Ի���ϵ������Ϊ�����ʺ�����
�������裺����Ʒ������ȷ��ȡһ�����Ĺ�����Ʒ�̷ۣ����������ձ��У�����һϵ�еĴ���������ȴ������һ�����������ƿ�С�
��NH3����������գ����Ƶõ���Һ(ȡһ����)ͨ������װ�ã�����һϵ�еķ�Ӧ��ʹ���������泥��پ�������������Ϊ����̬�����백���������ա�
�۰��ĵζ����ñ�������Һ�ζ������ɵ�����泥������ĵ������Һ������ܵ�����������Ϊ�ֵ�������
�Իش��������⣺
��1�������ƹ����У����������������ʹ���Ƶ���Һ��Ũ��ƫ��________(����ĸ)��
A���ձ�����Һת�Ƶ�����ƿ��ʱ��δϴ���ձ�
B������ʱ�����ӿ̶���
C������ʱ�����ӿ̶���
D����Һʱ��������Һ�彦��
��2������ȡ��Ʒ������Ϊ1.5 g��������100 mL����Һ��ȡ���е�20 mL������һϵ�д�����ʹNת��Ϊ����狀���0.1 mol��L��1����ζ�������ȥ��������Ϊ23.00 mL�������Ʒ��N�ĺ���Ϊ________(������λС��)��[��֪���ζ��������漰���ķ�Ӧ����ʽ��(NH4)2B4O7��2HCl��5H2O===2NH4Cl��4H3BO3]
���𰸡� B 10.73%
��������(1)A��������Һʱ���ձ�����Һת�Ƶ�����ƿ��ʱ��δϴ���ձ�������������ʧ��ʹ��ҺŨ��ƫС����A����B������ʱ�����ӿ̶��ߣ�������Һ�����С��ʹ��ҺŨ��ƫ��B��ȷ��C������ʱ�����ӿ̶��ߣ�������Һ�������ʹ��ҺŨ��ƫС����C����D�����ں������ʵ�Һ������ʹ���ʵ����ʵ�����С��������ҺŨ��ƫС����D������ȷ��ΪB��
(2) �ζ�ʱ������������ʵ���n(HCl)= 0.1 mol/L��0.023L=0.0023mol������ʾ�ķ�Ӧ����ʽ�ɵ�n(NH4+)= n(N)= n(HCl)=0.0023mol��������Ʒ��N�ĺ���Ϊ= 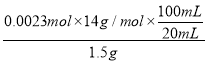 ��100%=10.73%��
��100%=10.73%��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ��ѧʵ���ҵij���ҩƷ���ش�����ʵ�����⡣
��.����һ�����ʵ���Ũ�ȵ�������Һ��
(1)ij��ʵ���Լ��Ҫ1mol/L������Һ435ml��ͬѧ�Ƿ���ʵ������û��450ml������ƿ��ijͬѧ������1��200ml����ƿ��1��250ml����ƿ�����ƣ�����Ϊ������_________(����������������������)��
(2)ʵ����Ҫ����0.5mol/L H2SO4��Һ250ml��������ȡ�ܶ�Ϊ1.84g/ml��98%��Ũ����________ml��

��.������Ũ�����̿��ʵ�������������д̼�����ζ�����壬��Ի��������Ⱦ��ijʵ��С����������װ�öԸ�ʵ����иĽ����ش��������⣺
ע��Ӳ�ʲ������Т��������۴��ֱ�Ϊ����Na2S��Һ����ֽ������Ʒ����Һ����ֽ����������KMnO4��Һ����ֽ��a��b�ֱ�Ϊ����С����
(1)ͼ��ʢװŨ�������������Ϊ________________��
(2)ʵ�鿪ʼ���ȹرջ���K��Ӳ�ʲ������Тٺ���ֽ��ƣ��ںź͢ۺ���ֽ����ɫ��a��������Ӳ�ʲ�������ʵ������˵��̿��ʵ������Ĵ̼�����ζ������SO2�����������۴������ı仯�ֱ�˵��SO2����_____________��_____________��_____________(��SO2���ֳ�������)��
(3)����K��a�������С��b��������ʹ������ƿ�����建��ͨ��Bƿ��Cƿ��һ��ʱ��֮���ֳ���ʯ��ˮ����ǡ�Ϊ֤����CO2���ɣ������ڢܺ�λ�õ���ֽ�μ�______________��Һ�����Լ���������_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����λ��ŵ���������ڻ�ѧ������ʢ���Ŀ�ѧ���� �� ��
A.����˹̹B.�����C.�������D.ŷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л�������������������ȷ���ǣ� ��
A.2��3��������2���һ�����
B.CH3CH2CH2Cl �ȱ���
C.![]() ���ڷ��㻯����
���ڷ��㻯����
D.![]() ��������
��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ������ҹ���Ϊ��˾�ļ�������Ϊ������5G��ͨѶ������Ҫ��ɲ��֡�������5G��ʱ�����������Թ��άΪ��������Ϣ����ͨ��������Ҫ��������ά�IJ����ǣ� ��
A. �����B. ��������C. ͭ�Ͻ�D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㡣��ҵ�Ͽɽ���м���������У�������FeCl2����ͨ��Cl2�������Ʊ�FeCl3��Һ��
��1������״���µ�a L�Ȼ�����������100 gˮ�У��õ�������ܶ�Ϊb g��mL��1�������������ʵ���Ũ����______________________��
��2����100 mL��FeBr2��Һ��ͨ���״����Cl2 3.36 L����Ӧ�����Һ��Cl����Br�������ʵ���Ũ����ȣ���ԭFeBr2��Һ�����ʵ���Ũ��Ϊ__________________��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ____________________________________(�����ӷ���ʽ��ʾ)����100 mL 2 mol��L��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����________(����������������������С����)0.2NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�����ܺ���Al3+��Ba2+��NH4+��Fe2+��Fe3+��CO32����SO42����SiO32����NO3���е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬������ת������ͼ����Ӧ��������һ�������Ǻ���ɫ�� 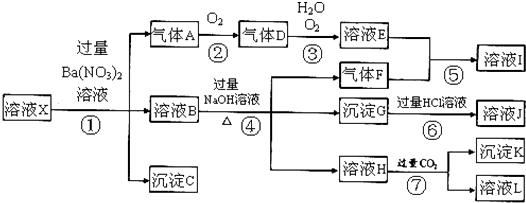
��ش��������⣺
��1����ǿ�������������ж���ҺX��һ�������ڵ���������
��2����ҺX�У�����NO3�����ж�һ����ȷ������
a��һ���� b��һ��û�� c��������
��3����������A�����ӷ���ʽΪ��
��4��ת��������Ӧ������Ϊ��
��5��ת�����в���H�����ӷ���ʽΪ��
��6����ת�����У�D��H2O��O2��������ǡ�÷������Ϸ�Ӧ����E����Ӧ��D��O2�����ʵ���֮��Ϊ��
��7���Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ������������Һ�е�һ�֣����������жϣ����Լ������ ��
��NaOH��Һ����KSCN��Һ����ʯ���Լ�����pH��ֽ����KMnO4��Һ������ˮ��KSCN�Ļ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¸�����������������ԭ��Ӧ�����ܴ���������ǣ� ��
A. Ca2����H����SO42-��HCO3-B. H����Fe2����SO42-�� NO3-
C. Na����Cu2����Cl����S2��D. Fe3����K����SCN����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ֻ�����Ӧ����,������������ԭ��Ӧ����( )
A. ![]()
![]()
![]() B.
B. ![]()
![]()
![]()
C. ![]()
![]()
![]() D.
D. ![]()
![]()
![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com