
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
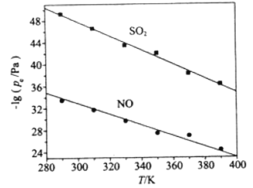
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32 2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
【答案】亚氯酸钠 4OH-+3ClO2-+4NO4NO3-+3Cl-+2H2O 提高 减小 大于 NO溶解度较低或脱硝反应活化能较高 减小 K=![]() 形成CaSO4沉淀,平衡向正反应方向移动,SO2转化率提高
形成CaSO4沉淀,平衡向正反应方向移动,SO2转化率提高
【解析】
(1)氯的价态为+7价时称为高、+3价时称为亚,据此命名NaClO2;
(2)亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中能够将NO氧化为NO3-,本身被还原为Cl-;结合压强对平衡的影响分析解答①和②;③SO2和NO在烟气中的初始浓度和反应的活化能均会影响反应速率;
(3)①根据图象,脱硫、脱硝反应中SO2、NO的平衡分压的负对数随温度的升高而减小,说明温度越高,SO2、NO的平衡分压越大,结合温度对平衡的影响分析解答;②根据K=![]() 书写K的表达式;
书写K的表达式;
(4)Ca(ClO)2与NaClO相比,Ca(ClO)2能够反应生成硫酸钙沉淀,降低硫酸根离子浓度,结合平衡的移动分析解答。
(1)氯的价态为+7价时称为高、+3价时称为亚,NaClO2中氯的化合价为+3价,化学名称为亚氯酸钠,故答案为:亚氯酸钠;
(2)①亚氯酸钠具有氧化性,且NaClO2溶液呈碱性,则NaClO2溶液脱硝过程中主要反应的离子方程式为3ClO2-+4NO+4OH-4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高,故答案为:3ClO2-+4NO+4OH-4NO3-+3Cl-+2H2O;提高;
②根据反应的方程式3ClO2-+4NO+4OH-4NO3-+3Cl-+2H2O可知,随着吸收反应的进行,氢氧根离子被消耗,吸收剂溶液的pH逐渐减小,故答案为:减小;
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高,故答案为:大于;NO溶解度较低或脱硝反应活化能较高;
(3)①由图分析可知,反应温度升高,脱硫、脱硝反应中SO2、NO的平衡分压的负对数随温度的升高而减小,说明温度越高,SO2、NO的平衡分压越大,NO的含量越高,即升高温度,平衡向逆反应方向移动,平衡常数减小,故答案为:减小;
②根据反应的方程式ClO2-+2SO32- 2SO42-+Cl-可知平衡常数K表达式为K= ![]() ,故答案为:K=
,故答案为:K=![]() ;
;
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,Ca(ClO)2与NaClO相比,Ca(ClO)2能够反应生成硫酸钙沉淀,降低硫酸根离子浓度,促使平衡向正反应方向移动,所以Ca(ClO)2效果更好,故答案为:形成CaSO4沉淀,降低硫酸根离子浓度,平衡向正反应方向移动,SO2转化率提高。


科目:高中化学 来源: 题型:
【题目】Ⅰ.已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目_______。
(2)若生成0.2mol的NO,则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2,写出该化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚类化合物以其独特的化学结构使其拥有重要的生理活性,在农药、医药、化工、香料和染料等领域发挥着重要的作用。下图是合成“氮-苯甲酰基-2-甲基-3吲哚乙酸甲酯”的路线

已知: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
回答下列问题
(1)B的结构简式为________,B分子中含有的官能团为________(填官能团名称)。
(2)反应③为取代反应,该反应的化学方程式为________。
(3)C的名称为________。
(4)A的结构简式为________,反应⑤的反应类型为________。
(5)B有多种同分异构体,其中与B含有相同官能团的同分异构体有________种。
(6)已知
参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.4gNaOH固体溶于水,配成100mL溶液,其密度为1.22g/mL,请回答下列问题。
(1)从该溶液中取出10mL,其中NaOH的物质的量浓度为________,NaOH的质量分数为___________,溶液的密度为________,含NaOH的物质的量为_________;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_______。
(2)用等体积的0.2mol·Lˉ1的BaCl2溶液,可使相同体积的Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )

A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ. 汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
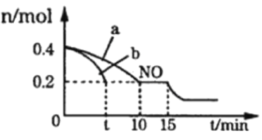
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=___________;T℃时,该反应的化学平衡常数K=_____________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(1)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A.混合气体颜色不再改变 B. 混合气体的密度不再改变
C.混合气体摩尔质量不再改变 D. NH3和NO2的物质的量之比不再改变
(3)将一定比例的O2、NH3和NO2的混合气体,匀速通入图(a)所示装有催化剂M的反应器中充分进行反应。
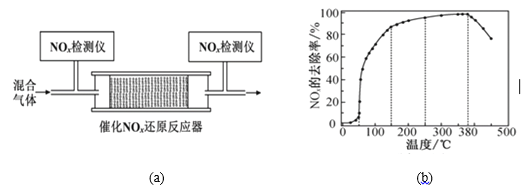
反应相同时间NOx的去除率随反应温度的变化曲线如图(b)所示。已知该催化剂在100~150℃时活性最高,那么在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢,其中去除率迅速上升段的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com