
 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )| A. | 配位键 | B. | 极性键 | C. | 离子键 | D. | 非极性键 |
科目:高中化学 来源: 题型:选择题
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$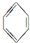

| A. | 反应①中间产物和反应②产物互为同分异构体 | |
| B. | 反应①中间产物和最终产物的一氯代物都只有一种 | |
| C. | 反应②产物中的六个碳原子可能在同一平面上 | |
| D. | 反应①②均为消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的系统命名是:2,6-二甲基辛烷
的系统命名是:2,6-二甲基辛烷 的键线式是
的键线式是
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,32g三氧化硫的体积约为11.2L | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随荷电荷数的增加而加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com