
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-38 |
分析 (1)该电池的正极发生还原反应,MnO2被还原生成MnOOH;负极锌被氧化生成Zn2+,以此书写电池总反应式;
(2)滤液中主要有ZnCl2和NH4Cl,根据溶解度的差异,可通过加热浓缩溶液,到一定程度NH4Cl析出,而ZnCl2保留在水中;填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化;
(3)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,结合Ksp=10-38计算pH,并根据Ksp计算锌开始沉淀的pH.
解答 解:(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH,负极锌被氧化生成Zn2+,电池总反应式为2MnO2+Zn+2H+=2MnOOH+Zn2+,
故答案为:MnO2+H++e-=MnOOH;2MnO2+Zn+2H+=2MnOOH+Zn2+;
(2)滤液中主要有ZnCl2和NH4Cl,根据溶解度的差异,可通过加热浓缩溶液,到一定程度NH4Cl析出,而ZnCl2保留在水中,达到分离的目的;填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰,
故答案为:加热浓缩;冷却结晶;在足量的空气或氧气中加热;
(3)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-38,
则c(OH-)=$\root{3}{\frac{1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=1×10-11mol/L,此时pH=3,
如锌开始沉淀,则c(OH-)=$\sqrt{\frac{1{0}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+不能分离,
故答案为:Fe3+;3;6;Zn2+和Fe2+不能分离.
点评 本题考查原电池知识以及物质的分离、提纯,侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有利于培养学生良好的科学素养.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )| A. | 配位键 | B. | 极性键 | C. | 离子键 | D. | 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
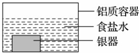 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是| A. | 该处理过程中电能转化为化学能 | B. | 银器为正极,Ag2S 还原为单质银 | ||
| C. | 铝质容器为阳极,其质量变轻 | D. | Ag2S 溶解于食盐水生成了 AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b 电极上的主要反应是:SO23--2e-+H2O═SO2 4-+2H+ | |
| B. | 若 D 是混合气体,则可能含有 SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有 1 mol Na+通过阳离子交换膜时,a 极生成 11.2 L 气体 | |
| D. | A 溶液是稀 NaOH 溶液,作用是增强溶液的导电性,C 是较浓的硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
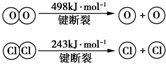 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.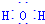 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 增大反应物的浓度、提高反应温度都能增大反应速率 | |
| D. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=4.8 mol/(L•min) | B. | v(A2)=1.5 mol/(L•s) | ||
| C. | v(C)=1.6 mol/(L•s) | D. | v(B2)=1.7 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
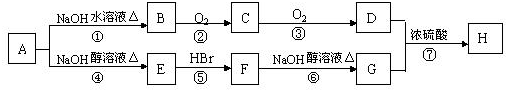
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com