
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随荷电荷数的增加而加深 |
分析 F、Cl、Br、I位于周期表同一主族,原子序数逐渐增大,半径逐渐增大,元素的非金属性逐渐减弱,则对应氢化物的稳定性质逐渐减弱,但颜色逐渐加深,
A.卤族元素的核外电子层数随着原子序数的增大而增多;
B.卤族元素简单阴离子的还原性随着原子序数的增大而增强;
C.元素的非金属性越强,其氢化物越稳定;
D.卤族元素单质的颜色随着核电荷数的增大而逐渐加深;
解答 解:A.F、Cl、Br、I原子核外电子层数分别为2、3、4、5,原子核外电子层数随核电荷数的增加而增多,故A正确;
B.卤族元素简单阴离子的还原性随着原子序数的增大而增强,所以被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大,故B正确;
C.F、Cl、Br、I元素的非金属性逐渐减弱,则对应氢化物的稳定性质逐渐减弱,故C错误;
D.F、Cl、Br、I单质的颜色分别为浅黄绿色、黄绿色、红棕色、紫色,颜色逐渐加深,故D正确;
故选C.
点评 本题考查了卤族元素性质的变化规律,主族非金属元素以卤族为例、主族金属元素以碱金属族为例熟记它们性质的变化规律,灵活运用这些知识解答问题,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
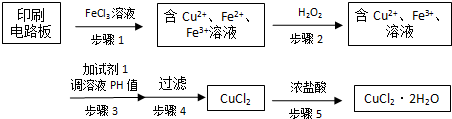
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )| A. | 配位键 | B. | 极性键 | C. | 离子键 | D. | 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇完全燃烧生成CO2和H2O | |
| B. | 0.1mol乙醇与足量的钠反应生成0.5mol氢气 | |
| C. | 乙醇能溶于水 | |
| D. | 乙醇能脱水. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.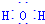 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com