
【题目】己知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×l0-39 | 1.7×l0-7 | 1.3×l0-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuC12·2H2O晶体,常加入CuO或Cu(OH)2,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuC12, 原因是(用化学方程式表示)_____________________________,由CuCl2·2H2O晶体得到纯净的无水CuCl2的合理方法是________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取1.44g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。将反应后的溶液稀释为100 mL,用0.1000mol/LNa2S2O3标准溶液(溶液呈弱碱性)进行滴定,滴定结果如下表所示。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.02 | 22.03 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.22 |
①可选用__________作滴定指示剂,滴定终点的现象是_________________________。
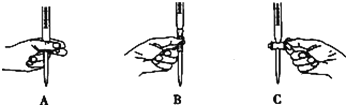
②滴定过程中操作滴定管的图示正确的是_____________。
③若滴定时出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶 b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.酸式滴定管滴至终点时俯视读数 d.酸式滴定管用蒸水洗后,未用标准液润洗
④CuCl2溶液与KI反应的离子方程式为______________________________。
⑤该试样中CuCl2·2H2O的质量百分数为____________________。
【答案】 2.6×10-9mol/L CuCl2+2H2O![]() Cu(OH)2+2HCl 在干燥氯化氢气流中加热 淀粉 滴入最后一滴标准液,溶液由蓝色变为无色且半分钟内不复原 B bd 2Cu2++4I-=2CuI↓+I2 95%
Cu(OH)2+2HCl 在干燥氯化氢气流中加热 淀粉 滴入最后一滴标准液,溶液由蓝色变为无色且半分钟内不复原 B bd 2Cu2++4I-=2CuI↓+I2 95%
【解析】(1)调至pH=4,c(H+)=10-4 mol/L, c(OH-)=10-10 mol/L, 根据公式Ksp= c(Fe3+)c3(OH-);c(Fe3+)×10-30=2.6×l0-39, c(Fe3+)= 2.6×10-9mol/L;正确答案:2.6×10-9mol/L;
(2)CuCl2的水溶液能够发生水解反应,生成少量的Cu(OH)2;正确答案为:CuCl2+2H2O![]() Cu(OH)2+2HCl;只有在不断通入氯化氢气流的情况下,抑制氯化铜的水解,才可以在直接加热情况下得到纯净的无水CuCl2;
Cu(OH)2+2HCl;只有在不断通入氯化氢气流的情况下,抑制氯化铜的水解,才可以在直接加热情况下得到纯净的无水CuCl2;
(3)①CuCl2氧化I-生成I2;然后用Na2S2O3标准溶液进行滴定含有碘单质的溶液,而淀粉溶液遇碘单质显蓝色,可以用淀粉做指示剂,达到滴定终点时,溶液由蓝色变成无色,且半分钟内溶液不恢复原来的颜色;正确答案:淀粉;滴入最后一滴标准液,溶液由蓝色变为无色且半分钟内不复原;
②Na2S2O3标准溶液显弱碱性,要用碱式滴定管进行盛装,答案选B。
③a.滴定前用蒸馏水冲洗锥形瓶,不影响溶液溶质的量,测定结果无影响,a错误; b.滴定前滴定管尖嘴有气泡,滴定后气泡消失,造成滴定管内液体的读数增大,相当于消耗滴定液的体积增大,结果偏高,b正确;c.酸式滴定管滴至终点时俯视读数,所量液体的体积偏小,结果偏低,c错误;d.酸式滴定管用蒸馏水洗后,未用标准液润洗,造成标准液的浓度变小,消耗的体积增大,结果偏高;d正确;正确选项:bd;
④CuCl2溶液与KI反应中,铜由+2价降低到+1价,生成CuI;-1价的碘升高到0价,生成单质碘;正确答案:2Cu2++4I-=2CuI↓+I2;
⑤根据图表可看出,消耗Na2S2O3标准溶液的体积分别为:22.01 mL、 19.98 mL、20.02 mL;第一组误差较大,用第二组和第三组数据求出消耗0.1000mol/LNa2S2O3标准溶液平均为20 mL; CuCl2与KI发生反应: 2Cu2++4I-=2CuI↓+I2;Na2S2O3滴定I2反应:2S2O32- + I2 =S4O62-+2I-;由上述反应关系可得:2Cu2+~I2~2 S2O32-,则有:n(S2O32-)=0.1000×20.00×10-3=2×10-3 mol,n(Cu2+)= 2×10-3 mol,n(CuCl2·2H2O)=n(Cu2+)= 2×10-3 mol, m(CuCl2·2H2O)= 2×10-3×171=0.342 g。试样中CuCl2·2H2O的质量分数为0.324÷0.36×100%=95%;正确答案为95%;


科目:高中化学 来源: 题型:
【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________________________。
(2)合成阿司匹林时,最合适的加热方法是______________________。

(3)提纯粗产品流程如下,加热回流装置如图:
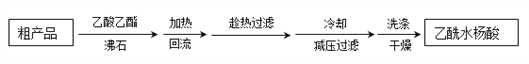
①沸石的作用是__________________________________;
②冷凝水的流出方向是________________(填“b”或“c”);
③使用温度计的目的是_____________________________________________________。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
【答案】蒸馏法电渗析法离子交换法还原 2NaCl(熔融)![]() 2Na+Cl2↑2NH4Cl+Ca(OH)2
2Na+Cl2↑2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
【解析】
海水淡化的常用方法有海水冻结法、电渗析法、蒸馏法、离子交换法;金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,原理就是利用氧化还原反应原理在一定条件下用还原剂把金属矿石中的金属离子还原成金属单质;实验室用消石灰与氯化铵共热的方法制备氨气,氨气溶于水溶液呈碱性,密度比水小;溴易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质。
(1)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等。(2)金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,工业上用电解熔融的氯化钠冶炼金属钠,反应的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2
2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
+3Br2+3H2O。
【题型】填空题
【结束】
27
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是人体细胞化合物含量的扇形图,图乙为人体内组成染色体的两种重要化合物A与C的化学组成关系,据图分析回答:

(1)若图甲表示细胞鲜重,则①化合物是_______,若图甲表示细胞干重,则①化合物是________,它在图乙中的物质是_______(用字母表示)。
(2)图乙中b分子通过______方式形成B,连接两个b分子的化学键叫做_______,若用结构式表示应为__________。
(3)在图乙中,a和b两种化合物其它的组成元素分别是_______、_______,化合物单体a的名称是________________。
(4)我们知道人的红细胞和心肌细胞的主要成分都是蛋白质,但这两种细胞的功能却完全不同,请你从蛋白质的结构方面做出解释_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列既能和盐酸反应,又能和烧碱溶液反应的物质是
①NaHCO3 ②(NH4)2CO3 ③Al ④Al2O3 ⑤Al(OH)3
A.①②③④⑤B.①③④⑤C.①③④D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) ![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) ![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内不同化学元素所组成的化合物,以下说法不正确的是( )

A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若③为多聚体,且能贮存生物的遗传信息,则③一定是RNA
C. 若②存在于皮下和内脏器官周围等部位,则②是脂肪
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
化学键 | C-C | C-H | Ge-Ge | Ge-H |
键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。
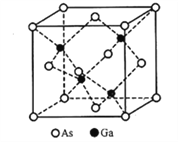
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com