
【题目】下列既能和盐酸反应,又能和烧碱溶液反应的物质是
①NaHCO3 ②(NH4)2CO3 ③Al ④Al2O3 ⑤Al(OH)3
A.①②③④⑤B.①③④⑤C.①③④D.①③④⑤
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】现有14.4gCO和CO2的混合气体,在标准状况下其体积为 8.96L。请回答下列问题:
(1)该混合气体的平均摩尔质量 为 _____。
(2)该混合气体 中碳原子的个数 为 _____;(用N A表示阿伏加德罗常数的值)
(3)将该混合气体依次通过如下图所示装置,最后收集在气球中(体积在标准状况下测定) .

气球中收集到的气体的摩尔质量 _____;
② 气球中收集到的气体的电子总数为 _____;(用 NA表 示阿伏加德罗常数的值 )
③ 标况下气球中收集到的气体的体 积为 _____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,铁片、铜片和CuSO4溶液可以构成原电池或电解池,下列说法正确的是( )

A. 构成原电池时,Cu极反应式为Cu-2e-=Cu2+
B. 构成电解池时,Cu极质量可能减少也可能增加
C. 构成电解池时,Fe极质量一定减少
D. 构成的原电池或电解池在工作时的反应原理一定不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeSO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
【答案】红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)3淡黄色固体向内NaOHNO3NO2+H2O = 2HNO3+NO黄绿色变为无色5
【解析】
+2价的铁离子易被氧气氧化成+3价的铁离子,NH3与FeSO4溶液的水反应生成Fe(OH)2沉淀,Fe(OH)2沉淀易被空气中的氧气氧化;H2S和SO2反应生成单质硫和水,过量的SO2用碱吸收;NO2与水反应生成硝酸和一氧化氮;氯气的颜色为黄绿色,氨气与氯气发生氧化还原反应生成氮气和氯化氢,3Cl2+2NH3═N2+6HCl,过量的氨气与产物氯化氢反应生成氯化铵。
(1)氨气溶于水得到氨水,反应的化学方程式为:NH3+H2ONH3H2O,氨水与硫酸亚铁溶液反应生成氢氧化亚铁白色沉淀,反应的化学方程式为:FeSO4+2NH3H2O═Fe(OH)2↓+(NH4)2SO4,Fe(OH)2白色沉淀,在空气中易被空气中的氧气氧化,迅速变成灰绿色,最终变为红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3。(2)15mLH2S和10mLSO2反应2H2S+SO2=3S+2H2O,反应产生固体硫和液态水,SO2过量,针筒内压强减小,活塞自动向内移动,析出浅黄色固体,过量的SO2用NaOH溶液吸收。(3)二氧化氮气体溶于水,与水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,由方程式可知可知30 mLNO2生成10mL无色的NO气体。(4)氯气的颜色为黄绿色,氨气与氯气发生氧化还原反应生成氮气和氯化氢,气体颜色变浅,反应的化学方程式为:3Cl2span>+2NH3═N2+6HCl,由方程式可知,15 mLCl2消耗10ml氨气、生成30ml氯化氢,过量的氨气与氯化氢恰好反应生成氯化铵,反应中有大量的白烟产生。
【点睛】
该题主要考查了元素及其化合物的知识,涉及氮、氯、硫的化合物的性质,注意根据化合物的性质认识理解化学反应,正确分析实验现象。
【题型】填空题
【结束】
30
【题目】有一瓶硫酸和硝酸的混合溶液(1)取出10.00mL该溶液,加入足量BaCl2溶液,过滤、洗涤、干燥得4.66g沉淀。滤液跟40 mL 2.00mol/L的NaOH溶液恰好反应使溶液呈中性,则混合液中硫酸和硝酸的物质的量浓度分别为多少____?(2)取出20.00mL该溶液,加入足量Cu粉,若氧化产物只有NO,可产生NO的物质的量是多少____ ?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×l0-39 | 1.7×l0-7 | 1.3×l0-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuC12·2H2O晶体,常加入CuO或Cu(OH)2,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuC12, 原因是(用化学方程式表示)_____________________________,由CuCl2·2H2O晶体得到纯净的无水CuCl2的合理方法是________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取1.44g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。将反应后的溶液稀释为100 mL,用0.1000mol/LNa2S2O3标准溶液(溶液呈弱碱性)进行滴定,滴定结果如下表所示。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.02 | 22.03 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.22 |
①可选用__________作滴定指示剂,滴定终点的现象是_________________________。
②滴定过程中操作滴定管的图示正确的是_____________。
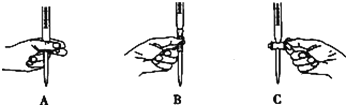
③若滴定时出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶 b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.酸式滴定管滴至终点时俯视读数 d.酸式滴定管用蒸水洗后,未用标准液润洗
④CuCl2溶液与KI反应的离子方程式为______________________________。
⑤该试样中CuCl2·2H2O的质量百分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图分别表示生物体内的生物大分子的部分结构模式图,据图回答下列问题:

(1)图甲中的三种物质的基本单位都是___________,其中属于动物细胞储能物质的是___________。这三种物质中,在功能上与另外两种截然不同的是______________________。
(2)图乙化合物是肺炎双球菌遗传物质的一部分,其基本单位是__________,可用图中字母_______表示,各基本单位之间是通过___________(填①、②或③)连接起来的。
(3)图丙所示化合物的名称是___________,是由___________种氨基酸经___________过程形成的,脱去水中的氢元素来自___________,连接氨基酸之间的化学键是___________(填化学键结构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素和化合物是生物体的生命活动共同的物质基础,图示中a、b是有机小分子,c代表化学元素,甲、乙、丙是生物大分子。请据图回答下列问题:

(1)甲、c分别是_________、__________。
(2)b在核糖体上通过______________方式结合成丙,b的结构通式可表示为___________。
(3)若丙由n个b形成,则丙(链状物质)中至少含有________个肽键,至少含有______个氮原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
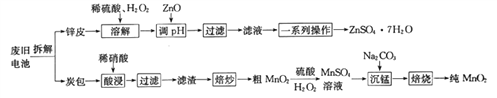
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com