
【题目】下列有关电解质溶液的叙述正确的是
A. 向Mg(OH)2悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH)均增大
B. 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均减小
C. 0.1 mol·L1 NaHCO3溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 0.01 mol·L1 Na2CO3溶液与0.01 mol·L1 NaHCO3溶液等体积混合一定存在:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+)
【答案】D
【解析】
A.Mg(OH)2悬浊液中存在平衡Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),加入NH4Cl固体,铵根离子结合氢氧根离子促进氢氧化镁溶解,c(Mg2+)增大,c(OH-)减小,故A错误;将pH=3的醋酸溶液稀释后,溶液中氢离子和醋酸根离子的浓度减小,KW不变,溶液中氢氧根离子浓度增大,错误;C.因为HCO3-水解大于电离,所以0.1 mol·L-1NaHCO3溶液中,c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;根据物料守恒知0.01 mol·L-1Na2CO3溶液与0.01 mol·L-1NaHCO3溶液等体积混合一定存在:3c(CO32-)+3c(HCO32-)+3c(H2CO3)=2c(Na+),故D正确;答案为:D。
Mg2+(aq)+2OH-(aq),加入NH4Cl固体,铵根离子结合氢氧根离子促进氢氧化镁溶解,c(Mg2+)增大,c(OH-)减小,故A错误;将pH=3的醋酸溶液稀释后,溶液中氢离子和醋酸根离子的浓度减小,KW不变,溶液中氢氧根离子浓度增大,错误;C.因为HCO3-水解大于电离,所以0.1 mol·L-1NaHCO3溶液中,c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;根据物料守恒知0.01 mol·L-1Na2CO3溶液与0.01 mol·L-1NaHCO3溶液等体积混合一定存在:3c(CO32-)+3c(HCO32-)+3c(H2CO3)=2c(Na+),故D正确;答案为:D。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题:
(1)标准状况下,2.24L Cl2的质量为__________g。
(2)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为__________。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32-质量之比为51:300,则这两种离子的物质的量之比为____________。
(4)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为______________mol/L(忽略混合前后溶液体积的变化)。
(5)3.5mol Ba(OH)2中约含有____________个OH-。
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为___________。
(7)把 200mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全.该混合溶液中c(Na+)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在一定条件下,可以发生R—CH![]() CH2+HX
CH2+HX![]()
A、B、C、D、E有如下转化关系:
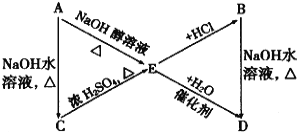
其中A、B分别是化学式为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1) B的结构简式:_________________________
(2) 完成下列反应的化学方程式:
①A→C__________________________________________________________________;
②E→D__________________________________________________________________;
Ⅱ.从樟科植物枝叶提取的精油中其中含有下列甲、乙两种成分:

(1)乙中含有的官能团的名称为______________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
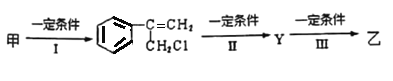
①反应I的反应类型是________________________;反应II的条件是_________________;
②反应III的化学方程式为__________________________________(不需注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(x)。纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气体,则C中n(A)∶n(B)为 ( )

A. 2∶1 B. 1∶2 C. 1∶1 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是
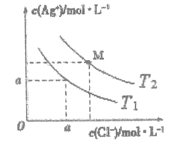
A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL溶液,放在棕色试剂瓶中避光保存,回答问题:
(1)配制该溶液所使用的玻璃仪器除烧杯和玻璃棒外还有_____。
(2)AgNO3溶液放在棕色试剂瓶中保存的原因是_________。
(3)下列情况对所配溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①转移液体后未洗涤烧杯:__________。
②摇匀后发现液面低于刻度线,再加水:______。
③容量瓶中原有少量蒸馏水:_______。
④定容时用俯视观察液面:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com