
【题目】某课外化学兴趣小组设计两组实验,研究KI 的性质。
Ⅰ.研究KI与FeCl3的反应,设计方案如下:

(1)请用离子方程式表示上述实验现象所得的结论___________________。
(2)小组成员经过讨论,认为还有必要做补充FeCl2溶液与碘水的实验,则该实验操作和相应现象是_____________________。
Ⅱ.为了研究KBrO3容液与KI溶液的反应。该小组查阅资料,得知氧化性强弱顺序为:
BrO3->IO3->Br2>Fe3+,并设计如下装置。电极均为碳电极,盐桥这的电解质为硫酸钾,在右池这加入加入100mL0.6mol/LKI溶液及少许淀粉溶液,左池中加入足量的稀硫酸,再通过滴定管逐渐滴加0.1mol/LKBrO3溶液,观察到以下现象:当滴加KBrO3溶液时,电流计的指针发生偏转,同时右电池的溶液变蓝,在连续滴加KBrO3溶液时,发现滴加过程中有一段时间电流计的指针不再偏转,再继续滴加,发现电流计的指针又开始偏转,同时右池溶液蓝色逐渐变浅。

(3)当开始滴加KBrO3 溶液时,右池中的电极反应式__________________。
(4)在不发生偏转的这段时间里,滴加的KBrO3溶液的体积为___________mL。
(5)当电流计的指针重新发生偏转时,左池中的电极反应式为_______________________。
(6)利用上述电化学装置,可以进行氧化还原反应的滴定,则判断其反应达到滴定终点方法
是___________________。称量10.0 g绿矾(FeSO4·7H2O) 固体溶于水,加入到上述装置的右池中,左池中先加入适量的稀硫酸,若终点时消耗0.25mol/ LKBrO3溶液20.00 mL,则 绿 矾的 质 量 分 数 为__________________。
【答案】 2Fe3++2I-![]() 2Fe2++I2 取FeCl2溶液于试管中,加入KSCN溶液,无现象,再加入碘水,溶液变红 2I--2e-=I2 10.00 2BrO
2Fe2++I2 取FeCl2溶液于试管中,加入KSCN溶液,无现象,再加入碘水,溶液变红 2I--2e-=I2 10.00 2BrO![]() +12H++10e-=Br2+6H2O 电流计的指针停止偏转 83.4%
+12H++10e-=Br2+6H2O 电流计的指针停止偏转 83.4%
【解析】(1)KI与FeCl3的反应后的溶液滴加淀粉,溶液变蓝说明溶液中含有碘单质,滴加KSCN溶液时溶液变红,说明溶液中含有Fe3+,该反应为可逆反应,用离子方程式表示上述实验现象所得的结论:2Fe3++2I-![]() 2Fe2++I2;(2)小组成员经过讨论,认为还有必要做补充FeCl2溶液与碘水的实验,则该实验操作和相应现象是:取FeCl2溶液于试管中,加入KSCN溶液,无现象,再加入碘水,溶液变红;(3)当开始滴加KBrO3溶液时,右池中溶液还是以KI为主,I-失电子产生I2,电极反应式为:2I--2e-=I2;(4)根据反应6H++6I-+ BrO3-=3I2+ Br-+3H2O,则在不发生偏转的这段时间里,滴加的KBrO3溶液的物质的量为
2Fe2++I2;(2)小组成员经过讨论,认为还有必要做补充FeCl2溶液与碘水的实验,则该实验操作和相应现象是:取FeCl2溶液于试管中,加入KSCN溶液,无现象,再加入碘水,溶液变红;(3)当开始滴加KBrO3溶液时,右池中溶液还是以KI为主,I-失电子产生I2,电极反应式为:2I--2e-=I2;(4)根据反应6H++6I-+ BrO3-=3I2+ Br-+3H2O,则在不发生偏转的这段时间里,滴加的KBrO3溶液的物质的量为![]() 0.1L
0.1L![]() 0.6mol/L=0.001mol。体积为
0.6mol/L=0.001mol。体积为![]() =0.01L=10mL;(5)当电流计的指针重新发生偏转时,左池中BrO3-得电子产生Br2,电极反应式为:2 BrO3-+12H++10e-=Br2+6H2O;(6)利用上述电化学装置,可以进行氧化还原反应的滴定,则判断其反应达到滴定终点时氧化还原反应完成,电流计的指针停止偏转;根据反应6Fe2++BrO3-+6H+=6Fe3++Br-+3H2O;可得:n(Fe2+)=0.02L
=0.01L=10mL;(5)当电流计的指针重新发生偏转时,左池中BrO3-得电子产生Br2,电极反应式为:2 BrO3-+12H++10e-=Br2+6H2O;(6)利用上述电化学装置,可以进行氧化还原反应的滴定,则判断其反应达到滴定终点时氧化还原反应完成,电流计的指针停止偏转;根据反应6Fe2++BrO3-+6H+=6Fe3++Br-+3H2O;可得:n(Fe2+)=0.02L![]() 0.25mol/L
0.25mol/L![]() 6=0.03mol,则绿矾的质量分数为
6=0.03mol,则绿矾的质量分数为![]() =83.4%。
=83.4%。
点睛离:本题考查氧化还原反应及原电池原理,必须根据氧化性强弱:BrO3->IO3->Br2>Fe3+,分析原电池中放电粒子的顺序,从而判断电极反应式,根据电极反应进行计算,算出溶液中离子浓度,从而得解。


科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是( ) ①0.5mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠.
A.④③②①
B.①④③②
C.②③④①
D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PMMA俗称有机玻璃,是迄今为止合成透明材料中质地最优异的一种,其合成线路如下图所示:

已知:在一定条件下可以发生如下反应:RCH2-X+NaOH→RCH2OH+NaX (X代表卤素)
回答下列问题:
(1) F的结构简式为___________,所含官能团的名称是__________。
(2)写出A的结构简式___________, 该过程中属于取代反应的有___________。
(3)写出③、⑤反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酶的叙述中正确的是 ( )
A.由有分泌功能的细胞产生,并且能调节生物体的生命活动
B.生物体内的酶在不断更新
C.都是在核糖体上合成的
D.与双缩脲试剂发生作用都可产生紫色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2 , 可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为  已知:
已知: ![]()
有关核黄素的下列说法中,不正确的是( )
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】推理是化学学习中常用的思维方法,下列推理合理的是
A. NaOH和CaCl2都是离子化合物,所以二者化学键类型相同
B. 可逆反应达平衡时,体系中各组分的浓度不再变化,可推知正、逆反应停止了
C. 原电池加快某些反应的速率,所以用锌与稀硫酸反应制取氢气常加入少量硫酸铜
D. 同条件下反应物浓度越大反应越快,所以铁在浓硝酸中比在稀硝酸中溶解得快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应. 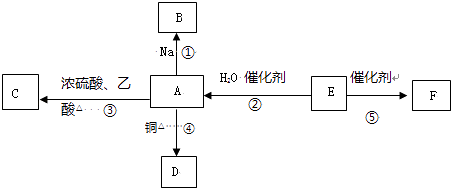
(1)请写出E的电子式 .
(2)下列反应的化学方程式:(要求有机物必须写结构简式) 反应②: 反应类型 .
反应④:反应类型 .
反应⑤:反应类型 .
(3)比较反应①剧烈程度(填>、=或<)钠和水反应的烈程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·Lˉ1 NaOH溶液至铜离子恰好完全沉淀,则消耗NaOH溶液的体积是
A. 15mL B. 30mL C. 45mL D. 60mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】睁大眼睛看仔细,找出错的是目的。下列有关说法错误的是
A. 乙烯的结构简式为CH2=CH2.
B. 镁原子的结构示意图为
C. 氯化钠的电子式![]()
D. 甲烷的比例模型![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com