
【题目】.按要求写出下列化学方程式或离子方程式。
(1)铝与氢氧化钠溶液反应的离子方程式_________________________________
(2)7.80g乙炔气体完全燃烧生成二氧化碳和液态水,放出389.9kJ的热量,写出反应的热化学方程式_______________________________
(3)氢氧燃料电池是最常见的燃料电池,电解质溶液通常是KOH溶液,写出负极电极反应式______________________________
【答案】.2Al+2OH-+2H2O=2AlO2-+3H2↑ 2C2H2(g) + 5O2(g) =4CO2(g)+2H2O(l) △H=-2599.2kJ·mol—1 H2-2e-+2OH-=2H2O
【解析】
(1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)0.3mol乙炔燃烧生成二氧化碳气体和液态水时,放出389.9kJ热量,则2mol乙炔完全燃烧生成二氧化碳和液体水放出热量为2599.2kJ;
(3)氢氧燃料电池中,氢气做负极,碱性条件下在负极放电生成水。
(1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)7.80g乙炔的物质的量为![]() =0.3mol,0.3mol乙炔燃烧生成二氧化碳气体和液态水时,放出389.9kJ热量,则2mol乙炔完全燃烧生成二氧化碳和液体水放出热量为
=0.3mol,0.3mol乙炔燃烧生成二氧化碳气体和液态水时,放出389.9kJ热量,则2mol乙炔完全燃烧生成二氧化碳和液体水放出热量为![]() =2599.2kJ,反应的热化学方程式为2C2H2(g) + 5O2(g) =4CO2(g)+2H2O(l) △H=-2599.2kJ·mol-1,故答案为:2C2H2(g) + 5O2(g) =4CO2(g)+2H2O(l) △H=-2599.2kJ·mol-1;
=2599.2kJ,反应的热化学方程式为2C2H2(g) + 5O2(g) =4CO2(g)+2H2O(l) △H=-2599.2kJ·mol-1,故答案为:2C2H2(g) + 5O2(g) =4CO2(g)+2H2O(l) △H=-2599.2kJ·mol-1;
(3)氢氧燃料电池中,氢气做负极,碱性条件下在负极放电生成水,电极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O。


科目:高中化学 来源: 题型:
【题目】下列图示且与对应的叙述不相符的是( )

A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
C.图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
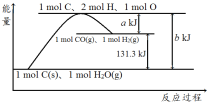
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述不正确的是

A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是合成某新型药物的中间体,下图是合成 G的部分流程:
已知:

乙酸酐的结构简式为![]()
请回答下列问题:
(1)G 中含氧官能团的名称是_______、________。
(2)反应 A→B 的化学方程式为________________。
(3)有机物 F的结构简式为_________________。
(4)反应 ④、⑤的反应类型分别是_________、___________。
(5)写出满足下列条件的 C 的同分异构体的结构简式______________________。
Ⅰ.苯环上只有两种取代基
Ⅱ.分子中只有 4 种不同化学环境的氢原子
Ⅲ.能与NaHCO3溶液反应生成 CO2
(6)以乙酸酐和![]() 为原料,制备
为原料,制备![]() 的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
![]() ______________
______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应的实验,方法正确且能达到实验目的的是




A.图1、检验电流的方向B.图2、蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.图3、石油的分馏D.图4、分离CCl4萃取碘水后的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热;⑥将稀硫酸换为98%的硫酸,其中可提高反应速率的措施有
固体;④加入少量水;⑤加热;⑥将稀硫酸换为98%的硫酸,其中可提高反应速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HS- + H2O![]() H3O+ + S2-B.CO2 + 2H2O
H3O+ + S2-B.CO2 + 2H2O![]() HCO3- + H3O+
HCO3- + H3O+
C.NH4++H2O![]() NH3H2O + H+D.HCO3- + OH-
NH3H2O + H+D.HCO3- + OH-![]() CO32- + H2O
CO32- + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com